-
急性胰腺炎是临床最常见的一类急腹症,多数为轻症且具有自限性,然而约20%的患者可发展为中度或重症胰腺炎。肝脏作为胰腺血液回流的第一站,随着炎症反应的出现最先发生损伤,与此同时肝内巨噬细胞库因肝损伤而激活,释放更多细胞因子和炎性介质从而加重胰腺炎程度[1]。在此过程中肝损伤的主要病理基础为肝细胞脂肪变性。既往研究表明,磁共振成像(MRI)同反相位序列信号改变与电子计算机断层扫描(CT)密度衰减可有效诊断这一病例改变[2],但尚未有文章分析单一T2WI压脂序列与病理改变诸如淤血、水肿、肝细胞浊肿变性、实质点状坏死及出血的相关性及其诊断价值。本研究以肝功能生化指标谷丙转氨酶(ALT)、总胆红素(TBIL)、白蛋白(ALB)作为金标准,并通过ROC曲线分析磁共振T2WI压脂序列肝损伤影像表现的诊断效能,评价MRI对于急性胰腺炎合并肝损伤的诊断价值。
-
1 资料与方法
-
1.1 一般资料
-
通过电子病历系统及图像存储与传输系统回顾性收集2019年1月—2023年1月天津市南开医院收治的急性胰腺炎患者,纳入标准:1)18~70岁,男女不限;2)西医诊断标准参照《中国急性胰腺炎诊治指南(2021)》[3];3)首次患病且症状发作到入院时间<48 h。排除标准:1)复发、慢性胰腺炎病史、创伤性胰腺炎;2)严重的慢性疾病,如心衰、慢性阻塞性肺疾病、恶性肿瘤、肝肾功能不全;3)药物过敏史、药物滥用所致药物性肝损伤。按照上述纳排标准,本研究纳入134例急性胰腺炎患者,具体筛选流程见图1。其中男85例,女49例;年龄(48.55±12.58)岁,合并高血压37例(28%),糖尿病24例(18%),冠心病7例(5%),吸烟49例(37%),高血脂26例(19%),胆石症72例(54%)。本研究通过我院伦理委员会批准(审批号:NKYY-DWLL-2023-074)。
-
1.2 检查方法
-
所有患者均行MRI检查,设备采用Philips Achieva1.5T超导磁共振成像系统(飞利浦,荷兰)进行检查,使用8通道腹部线圈,患者体位采取头先进、仰卧位,剑突对准线圈中心。所有患者先行腹部常规序列扫描,后行T2频率选择饱和技术压脂序列(T2W_SPIR_HR),T2W_SPIR_HR扫描序列参数如下:视野(field of view,FOV)=460 mm×371 mm,层厚(Slice,S)=3 mm,重复时间(repetition time,TR)=903 ms,回波时间(echedelay time,TE)=80 ms,信号平均次数(number of signal average,NSA)=1,扫描时间(scan duration,SD)=72 s。
-
图1 研究对象纳入和排除标准
-
1.3 图像分析
-
由2名具备10年以上经验的高年资影像医师(观察者A、观察者B)于心影PACS工作站(ver 2.0)采用双盲法对MRI图像进行分析;为避免回忆偏倚,其中1位医师(观察者A)于2周后对患者影像资料重复分析。在T2W_SPIR_HR图像上记录患者胆囊水肿、肝脏水肿、门静脉周围淋巴水肿的情况,影像征象及分析标准见表1、图2及图3[4]。
-
1.4 实验室检查
-
使用电子病历系统检索患者MRI检查前后2天内的肝功能、尿淀粉酶(Amy-u)及C反应蛋白(CRP)检查结果,正常参考值:Amy-u:47~458 U/L; CRP:0.068~8.2 mg/L; ALT:5~40 U/L; TBIL:5.1~20.4; ALB:35~55 g/L。肝损伤诊断标准如下:1)ALT水平大于3倍正常值;2)TBIL水平大于2倍正常值;3)ALB水平小于30 g/L,三者任一指标出现异常,视为存在肝损伤[5]。
-
图2 急性胰腺炎肝功能正常患者的T2WI压脂序列表现
-
图3 急性胰腺炎合并肝损伤MRI表现
-
1.5 统计学分析
-
使用Medcalc 19.5.3.0软件进行数据分析。正态分布的计量资料以均数±标准差()表示,组间比较采用两独立样本t检验,肝损伤影像评估结果对肝损伤的诊断效能使用ROC曲线分析,并根据DeLong检验比较每种征象间诊断效能的差异。观察者间及观察者内影像征象识别的一致性使用Kappa检验,标准如下:0.0~0.2,一致性极低;0.2~0.4,一致性一般;0.4~0.6,一致性中等;0.6~0.8,一致性较强;0.8~1.0,一致性很强。P <0.05为差异有统计学意义。
-
2 结果
-
2.1 急性胰腺炎患者生化指标
-
根据实验室检查诊断标准,本组134例急性胰腺炎患者中,肝损伤患者90例,肝功能正常患者44例,肝损伤组的Amy-u、CRP、ALT、TBIL明显高于肝功能正常组,ALB低于肝功能正常组,差异有统计学意义(P<0.05)。见表2。
-
注:a与肝功能正常组比较,P<0.05
-
2.2 急性胰腺炎合并肝损伤MRI影像征象
-
根据影像诊断标准,肝损伤患者73例,其中40例患者出现了肝脏水肿,T2WI压脂序列肝脏呈等信号;33例患者出现门静脉周围淋巴水肿、门静脉周围可见条状T2WI压脂序列高信号;37例患者胆囊壁增厚、呈T2WI压脂序列高信号。三种肝损伤MRI征象的评估具有较高一致性(κ>0.8),有统计学意义。见表3。
-
注:aP<0.05
-
2.3 肝损伤影像征象诊断效能
-
肝脏水肿、门静脉周围淋巴水肿、胆囊壁水肿诊断胰腺炎合并肝损伤的AUC值分别为0.67、0.65、0.67,其敏感度分别为0.41、0.34、0.39,特异度分别为0.93、0.95、0.95。三者联合诊断AUC为0.82,敏感度为0.76,特异度为0.89。见表4及图5。
-
2.4 肝损伤MRI联合诊断与CT诊断比较
-
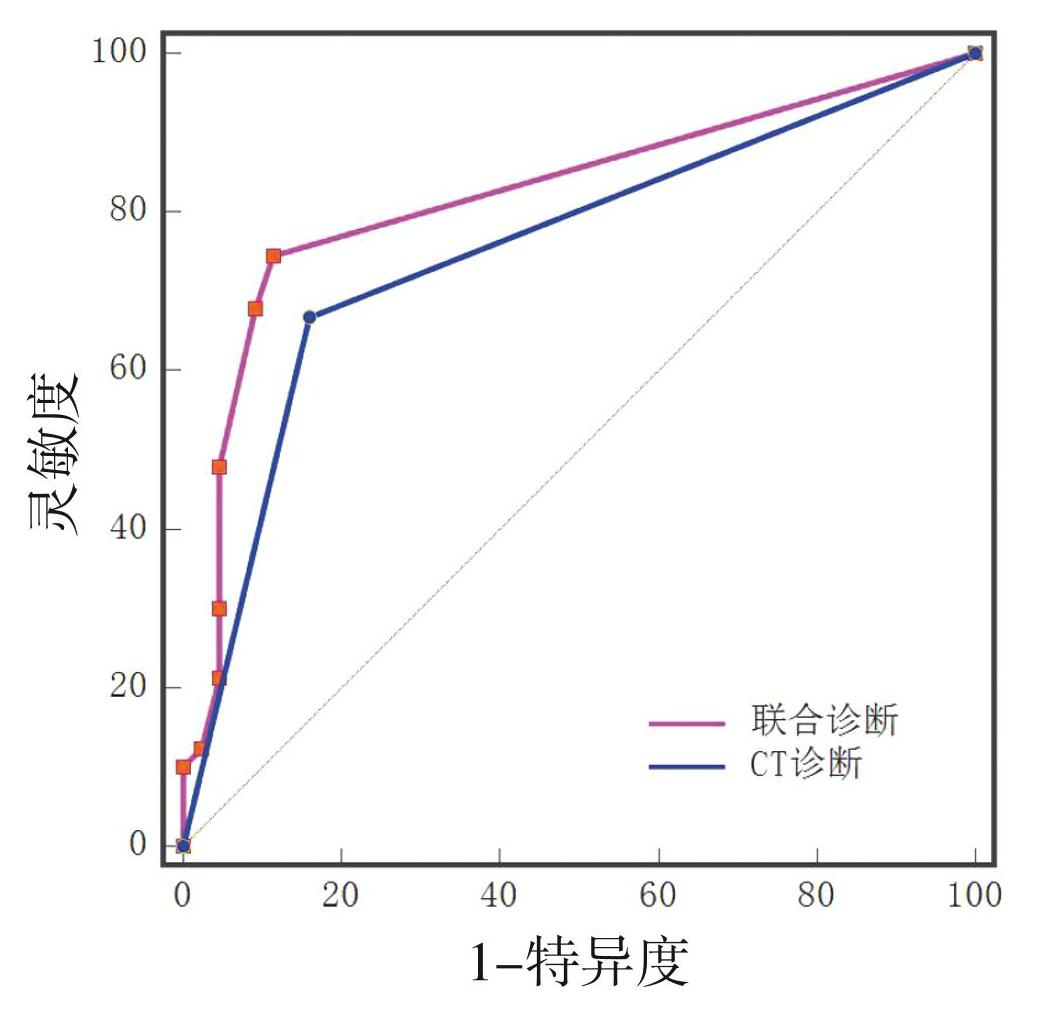
胰腺炎合并肝损伤的CT诊断标准为肝脏CT值较同一扫描平面脾脏CT值减低,同一患者的CT检查有67例出现肝脏CT值衰减,与MRI征象肝脏水肿+胆囊壁水肿+门静脉周围淋巴水肿联合诊断肝损伤的一致强(kappa值=0.866)。CT诊断胰腺炎合并肝损害的AUC为0.75,低于MRI诊断肝损害的诊断效能(AUC=0.82,P<0.05)。见图6。
-
图5 肝脏水肿、门静脉周围淋巴水肿、胆囊壁水肿、两两及三者联合诊断的ROC曲线
-
图6 CT诊断与MRI征象肝脏水肿+胆囊壁水肿+门静脉周围淋巴水肿联合诊断的ROC曲线
-
3 讨论
-
急性胰腺炎合并肝损伤涉及诸多病理机制,胰腺炎患者发病后炎症组织内能释放各种破坏因子,如肿瘤坏死因子-α和白细胞介素-6,通过静脉回流肝脏,并在肝脏损伤中起主要作用[6]。由于大量胰腺蛋白酶释放到门脉循环中,网状内皮系统功能受损导致枯否细胞的吞噬作用受到干扰,肝外器官吞噬作用的增加不足以弥补急性胰腺炎引起的枯否细胞功能受损。这些活化的吞噬细胞释放的组织破坏因子、介质或细胞因子可能导致组织损伤,并进一步导致胰腺外器官衰竭[7]。本研究中,肝损伤组患者胰腺炎相关炎症指标(淀粉酶、C反应蛋白)均明显高于肝功能正常组,而炎症指标的增高提示病情的进展[8],因此及时改善患者肝功能将有效缩短患者胰腺炎病程,并减少不良事件出现的可能。
-
肝实质信号于T2WI压脂序列弥漫增高可以反映肝细胞内脂质积累导致的氧化应激及炎症过程[10];而在排除胆囊结石/胆囊炎(墨菲征阳性、胆囊窝积液)的存在后,T2WI压脂序列胆囊壁高信号则提示急性肝病导致的胆囊壁水肿[11];门静脉周围条状T2WI压脂序列高信号则提示炎症/毒性反应诱导血管和(或)淋巴管通透性增加所产生的门静脉周围淋巴水肿[12]。本研究结果显示,上述三种影像表现在T2WI压脂序列易与观察且评估一致性较高(κ>0.8),作为联合诊断模型可以明显提高诊断效能(AUC=0.82),且优于肝损伤的CT诊断效果(AUC=0.75,P<0.05)。因此临床可通过上述MRI参考标准来干预胰腺炎进程(如保肝、评估胰腺炎严重程度及治疗效果)。肝脏水肿+胆囊壁水肿+门静脉周围淋巴水肿联合诊断模型的诊断敏感度为76%,明显高于其他MRI诊断模型,而特异度为89%,与其他MRI诊断模型无明显差别;可能原因为三种MRI征象对应一种或多种肝损伤病理(肝细胞损伤性、胆汁淤积型及混合型),任一病理类型的出现均应考虑存在肝损伤,单一或两两MRI征象用于急性胰腺炎肝损伤诊断容易造成漏诊,三种征象联合应用可有效避免这一情况出现。MRI T2WI压脂序列上可以得到成熟脂肪组织抑制信号,并清晰显示肝内病变及水肿信号,以检出CT阴性肝损伤患者[9];故本研究CT诊断肝损伤的敏感度及AUC均低于MRI征象肝脏水肿+胆囊壁水肿+门静脉周围淋巴水肿联合诊断。既往研究表明,肝损伤影像评估涉及多个MRI检查序列,包括T1/T2加权成像、扩散加权成像、钆塞酸二钠多期增强检查[4],而本研究仅采用T2WI压脂序列评估肝损伤,可明显减少检查成本。
-
ALT、ALB、TBIL均是目前临床应用于反映肝损伤的血清学指标。既往研究表明肝损伤的发生与胰腺炎严重程度密切相关,单一血清学指标对胰腺炎合并肝损伤患者病情评估能力有限,而三者联合应用可明显提高诊断效能,故本研究联合三种肝功能指标来评估肝损伤情况[13]。谷草转氨酶(AST)作为反映肝损伤的另一项指标,在反映损伤严重程度时最有效。本研究仅通过影像学表现判断胰腺炎患者急性肝细胞损伤存在与否,此时ALT敏感度优于AST,故本研究首选患者ALT作为急性胰腺炎合并肝损伤评估的生化指标[14]。
-
综上所述,T2WI压脂序列可作为评价急性胰腺炎患者是否合并肝功能损伤的有效手段,联合肝脏水肿、门静脉周围淋巴水肿、胆囊壁水肿MRI诊断可提高诊断效能,为急性胰腺炎患出现肝功能损伤的预防和诊治提供依据。
-
参考文献
-
[1] Mann DV,Hershman MJ,Hittinger R,et al.Multicentre audit of death from acute pancreatitis[J].Br J Surg,1994,81(6):890-893.
-
[2] 唐文杰,郭若汨,张丽娜,等.磁共振成像在感染性胰腺炎合并肝脏损伤患者中的诊断评价[J].中华医院感染学杂志,2017,27(14):3259-3262.
-
[3] 中华医学会外科学分会胰腺外科学组.中国急性胰腺炎诊治指南(2021)[J].浙江实用医学,2021,26(6):511-519,535.
-
[4] Wu T,Yang DW,Wee A,et al.Identification of MRI features associated with injury type,severity,and prognosis in drug-induced liver injury[J].Eur Radiol,2023,33(1):666-677.
-
[5] Senior JR.Alanine aminotransferase:a clinical and regulatory tool for detecting liver injury-past,present,and future[J].Clin Pharmacol Ther,2012,92(3):332-339.
-
[6] Wang YL,Liu WY,Liu XQ,et al.Role of liver in modulating the release of inflammatory cytokines involved in lung and multiple organ dysfunction in severe acute pancreatitis[J].Cell Biochem Biophys,2015,71(2):765-776.
-
[7] Wang XD,Zhao X,Shi CB,et al.Potential mechanisms and significance of acute pancreatitis-associated liver injury[J].Scand J Gastroenterol,2006,41(5):604-613.
-
[8] Staubli SM,Oertli D,Nebiker CA.Laboratory markers predicting severity of acute pancreatitis[J].Crit Rev Clin Lab Sci,2015,52(6):273-283.
-
[9] 石玲.应用CT、MRI及DWI对胰腺炎肝损害的初步研究[J].中国医学创新,2021,18(24):181-185.
-
[10] Chundru S,Kalb B,Arif-Tiwari H,et al.MRI of diffuse liver disease:characteristics of acute and chronic diseases[J].Diagn Interv Radiol,2014,20(3):200-208.
-
[11] Shu J,Zhao JN,Han FG,et al.Oedema of gallbladder wall:correlation with chronic hepatitis B on MR imaging[J].Radiol Med,2013,118(7):1102-1108.
-
[12] Barakat F,Kaisers U,Busch T,et al.Periportal oedema of the liver:correlation with clinical and paraclinical parameters in polytraumatic patients[J].Clin Imaging,2009,33(1):39-43.
-
[13] 张丽娇,黎晓琴,刘红,等.血清淀粉酶及肝损伤相关指标在急性胰腺炎病情评估中的应用[J].分子诊断与治疗杂志,2023,15(1):141-144.
-
[14] 雷燕,唐伟,蒋兴亮.肝功能生化指标与急性胰腺炎APACHEⅡ评分及影像分型的相关性分析[J].国际检验医学杂志,2013,34(18):2372-2373.
-
摘要
目的:探讨磁共振T2WI压脂序列对于急性胰腺炎患者合并肝功能损伤的诊断价值。方法:回顾性分析2019年1月—2023年1月就诊于天津市南开医院的134例急性胰腺炎患者的腹部MRI影像及临床资料。根据实验室肝功能检查,包括谷丙转氨酶(ALT)、总胆红素(TBIL)、白蛋白(ALB)将入组患者分为肝功能损伤组(n=90)及肝功能正常组(n=44),分析所有患者的腹部MRI影像征象,记录肝脏水肿、门静脉周围淋巴水肿、胆囊壁水肿的出现频数,并根据分组以生化检查为金标准绘制三种征象的独立及联合诊断胰腺炎合并肝功能损伤的受试者工作特征(ROC)曲线,通过比较ROC曲线下面积(AUC),阐明三种MRI征象(肝脏水肿、胆囊壁水肿、门静脉周围淋巴水肿)对急性胰腺炎合并肝功能损伤的诊断价值。结果:肝功能损伤组的炎症指标淀粉酶及C反应蛋白明显高于肝功能正常组(P<0.05)。肝脏水肿、门静脉周围淋巴水肿、胆囊壁水肿三种肝损伤MRI征象的评估具有较高的观察者间及观察者内一致性(κ>0.8),其诊断胰腺炎合并肝损害伤的AUC值分别为0.67、0.65、0.67,其敏感度分别为0.41、0.34、0.39,特异度分别为0.93、0.95、0.95。肝脏水肿+胆囊壁水肿+门静脉周围淋巴水肿联合三者联合诊断AUC提高至0.82,敏感度为0.76,特异度为0.89。结论:联合T2WI压脂序列上肝脏水肿、门静脉周围淋巴水肿、胆囊壁水肿的影像特征,可提高肝功能损伤的诊断效能,为急性胰腺炎患出现肝功能损伤的提供预防和诊治依据。
Abstract
Objective To evaluate the diagnostic value of magnetic resonance imaging (MRI) T2WI-fat-suppression sequence for acute pancreatitis-associated liver injury. Methods A retrospective analysis was performed on 134 patients with acute pancreatitis who underwent MRI examination for the first time in Tianjin Nankai Hospital from January 2019 to January 2023. According to laboratory information of liver function, including ALT alanine aminotransferase (ALT), total bilirubin (TBIL), and albumin (ALB), the enrolled patients were divided into liver function injury group(n=90) and liver function normal group(n=44). The abdominal MRI imaging signs of all patients were analyzed, and the frequency of liver edema, periportal oedema and gallbladder wall edema was recorded. The independent and combined receiver operating characteristic (ROC) curves of three signs were drawn based on biochemical examination as the golden standard according to grouping. By comparing the area under the ROC curve (AUC), the diagnostic value of the three MRI signs(liver edema, periportal lymphedema, and gallbladder wall edema) for acute pancreatitis-associated liver function injury was elucidated. Results liver function injury group's inflammatory index amylase and C-reflection protein were significantly higher than liver function normal group(P <0.05). The interobserver and intraobserver agreement of liver edema, periportal lymphedema, and gallbladder wall edema were high in diagnosing pancreatitis-associated liver injury(κ>0.8). The AUC values of liver edema, periportal lymphedema, and gallbladder wall edema in diagnosing pancreatitis-associated liver injury were 0.67, 0.65, 0.67, respectively, their sensitivity were 0.41, 0.34, 0.39, specificity were 0.93, 0.95, 0.95. The AUC, sensitivity for the liver edema+ periportal lymphedema+gallbladder wall edema combined diagnosis of pancreatitis-associated liver injury were improved to 0.82, the sensitivity were 0.76,and the specificity were 0.89. Conclusion T2WI-fat-suppression sequence can be used as an effective means to evaluate whether patients with acute pancreatitis are complicated with liver injury. Combined MRI features of liver edema, periportal oedema, and gallbladder wall edema can improved the diagnostic efficiency and provide prevention and treatment basis for patients with acute pancreatitis-associated liver injury.