-
阴茎硬结症(peyronie's disease,PD)是以阴茎海绵体白膜纤维化为主要表现的阴茎组织损伤。近年来,PD发病率逐年升高,全球发病率约为0.4%~3.5%[1-2]。纤维化的白膜及海绵体功能受损,导致阴茎勃起受限,严重时致阴茎畸形、异常弯曲。然而,目前对于PD的研究较少,机制尚不明确,且缺乏有效的治疗药物,是目前临床中的难点问题。
-
中医理论认为,气滞痰凝、痰瘀互结为PD的基本病理变化。小金丸出自《外科证治全生集》,具有消肿散结,化瘀止痛的作用,临床上常用于治疗痰气凝滞所致乳岩、乳癖、PD等疾病[3-4]。现代药理研究表明,小金丸具有解热、抗炎、抗菌、镇痛、抗肿瘤、抗血小板聚集、促进血液循环、抗凝血和血栓形成、增强机体免疫功能等作用[5]。课题组前期临床研究也发现小金丸能够改善PD患者的勃起功能[6]。但小金丸基于何种机制治疗本病,尚不清楚。Toll样受体4(toll-like receptors,TLR4)是一种能够跨膜传递信号的蛋白质分子,具有非特异性免疫特性,能够调控多个下游因子,干预多个生物过程,其中调节p38丝裂原活化蛋白激酶(mitogen-activated protein kinases,MAPK)干预炎症反应。研究显示,抑制TLR4-MAPK信号通路表达可减轻急性肺损伤小鼠肺组织的炎症反应[7]。此外研究显示TLR4-p38MAPK通路下调可减轻小鼠肝脏炎症反应,减少病原菌。PD发病机制与局部组织损伤后炎症反应和组织纤维化相关[8]。本研究从TLR4-p38MAPK-MMP1介导的抗纤维化入手,研究PD的发病机制及小金丸治疗PD的可能机制。
-
1 材料与方法
-
1.1 实验动物及分组
-
18只12周左右雄性SD大鼠(质量450 g左右)购自北京维通利华公司,批号:SCXK-2011-0011。随机将大鼠分为3组:对照组、模型组、小金丸治疗组,每组6只,分笼饲养,每组一笼,置于室温16~22℃,湿度45%~55%环境饲养,所有大鼠参照饲养标准自由饮食,昼夜节律规律。安静、温暖避强光环境中饲养1周。
-
1.2 主要试剂及仪器
-
小金丸(杭州胡庆余堂药业有限公司,国药准字Z33020158,规格:6 g/100丸);主要试剂:转化生长因子β1(TGFβ1)试剂(美国PeproTech公司,批号:AF-100-21C);蛋白提取试剂盒(武汉博士德生物公司,批号:AR0102);BCA蛋白定量试剂盒(上海碧云天生物技术公司,批号:P0010);PVDF膜(美国Millipore公司,批号:ISEQ00010);SDS-PAGE凝胶试剂盒(西安晶彩生物公司,批号:JCPE022);RNA提取和检测试剂盒(批号:MD435)、TLR4一抗(批号:MD345)、p38MAPK一抗(批号:MD133)、MMP1一抗(批号:MD815)均购自北京MDL公司。ECL发光液(批号:34580)、羊抗兔二抗(批号:A32727)及RT-PCR仪(型号7500Fast)均购自美国赛默飞公司;凝胶系统(美国UVP公司,型号GelDoc-It310);SDS-PAGE凝胶电泳系统(型号Mini-PROTEAN)、Western Blot化学发光成像系统(型号170-8280)购自美国Bio-Rad公司;脱水机(型号JJ-12J)、包埋机(型号JB-P5)购自武汉俊杰电子有限公司;病理切片机(上海徕卡仪器有限公司,型号RM2016);显微镜(Nikon,型号E100)。
-
1.3 大鼠分组及处理
-
1.3.1 大鼠模型制备
-
选择目前使用较多的TGF-β1注射法制备PD大鼠模型。参考Bivalacqua等[9]的方法,沿纵轴切开阴茎,暴露白膜,将0.5 μg TGF-1β因子(50 μL生理盐水溶液)一次注射于大鼠阴茎海绵体白膜下,缝合切口。常规饲养6周后,留取阴茎标本,切片并行HE染色。HE染色显示阴茎海绵体纤维化为建模成功的标志[10]。对照组大鼠一次阴茎海绵体白膜下生理盐水(50 μL)注射,然后饲养6周,双蒸水灌胃处理4周,留取阴茎标本。
-
1.3.2 干预方式
-
对照组:进行双蒸水灌胃处理4周;建立模型大鼠,随机分为2组,即模型组和治疗组(各6只),模型组:进行双蒸水灌胃处理4周;小金丸治疗组:小金丸磨粉,配以双蒸水制备小金丸溶液,根据文献中的标准[11],按丸质量计200 mg/kg的浓度灌胃处理4周,留取阴茎标本。
-
1.4 方法
-
1.4.1 病理HE染色
-
留取阴茎标本后(去除阴茎上皮组织,取硬结部分),用4%多聚甲醛固定至少24 h,然后用石蜡包埋,将切片浸入二甲苯中进行脱蜡处理,然后将切片浸入不同浓度酒精中进行梯度脱水,并先经过水洗,然后苏木素进行染色,染色后在进行水洗,下一步进行酒精梯度分化及伊红染色,采用不同浓度梯度酒精进行脱水处理,二甲苯透明,封片,显微镜下观察组织形态学上的变化。
-
1.4.2 PCR检测TLR4-p38MAPK-MMP1 RNA表达
-
依据RNA提取试剂盒说明,进行组织和细胞RNA提取,荧光定量PCR使用SYBR荧光染料试剂盒,SYBR染料可特异地进入DNA双链,然后发出荧光。实验中内参选用U6,并选用SYBR Green染料标记RNA,进行转录并检测RNA表达量。根据2-△△Ct计算每对样本的相对表达量。
-
1.4.3 蛋白印迹法(western blot)检测TLR4-p38MAPK-MMP1蛋白表达
-
提取阴茎硬结组织,加入裂解液并充分研磨,4℃,12 000 r/min离心10 min,取上清液进行BCA蛋白定量,根据结果,选取50 μg样本,缓冲,变性10 min,离心,上样,根据试剂盒说明书配置目的蛋白的分离胶和浓缩胶,进行蛋白电泳,除去浓缩胶后,转膜,配置浓度为5%的脱脂奶粉溶液,封闭,依次进行一抗孵育、二抗孵育,化学发光法检测。利用Image J软件分析蛋白表达的灰度值,蛋白相对表达量为目的蛋白/内参基因蛋白。
-
1.5 统计学分析
-
实验结果数据采用SPSS19.0统计软件进行统计分析,统计描述采用表示,统计推断采用方差分析,进一步两两比较采用LSD-t检验,P<0.05为差异有统计学意义。
-
2 结果
-
2.1 HE染色
-
模型组的纤维化程度强于对照组,小金丸治疗组纤维化程度明显低于模型组,见图1。
-
图1 各组大鼠阴茎HE染色结果(×10)
-
2.2 PCR检测结果
-
对照组和治疗组TLR4 RNA表达量(0.85±0.04、1.04±0.05)低于模型组(1.28±0.05),对照组和治疗组p38MAPK RNA表达量(0.96±0.3、1.06±0.05)低于模型组(1.52±0.04)、对照组和治疗组MMP1 RNA表达量(0.49±0.03、1.39±0.03)低于模型组(1.92±0.03),差异有统计学意义(P<0.01),见图2。
-
图2 各组大鼠阴茎组织TLR4、MAPK、MMP1 RNA相对表达量比较
-
2.3 Western Blot检测结果
-
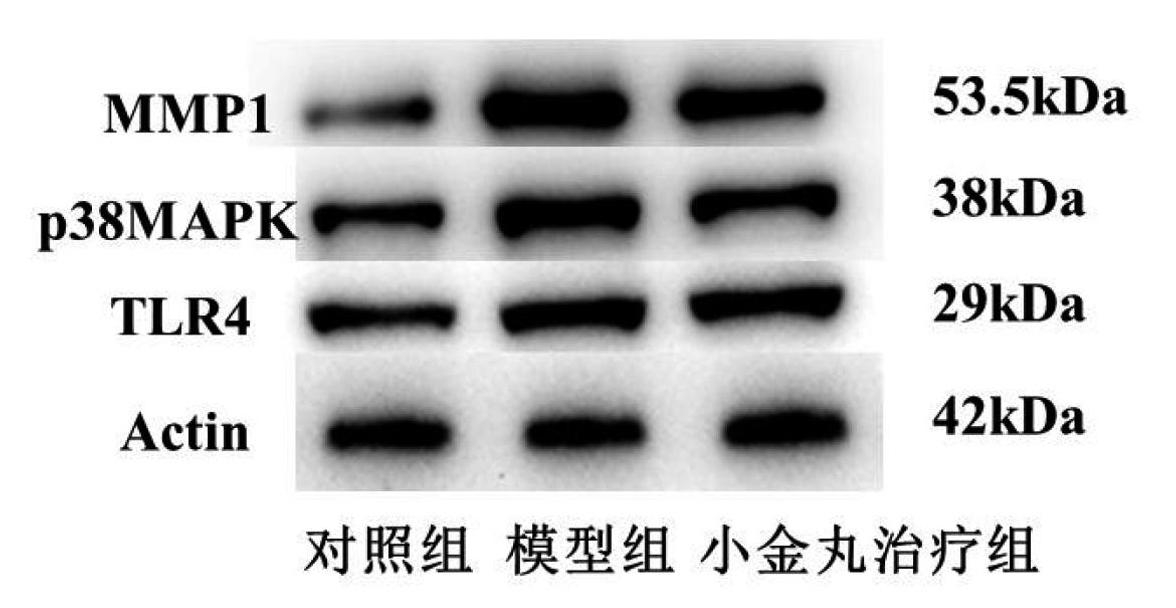
对照组和治疗组TLR4蛋白表达量(0.88±0.06、0.99±0.04)低于模型组(1.28±0.03),对照组和治疗组p38MAPK蛋白表达量(0.94±0.03、1.09±0.07)低于模型组(1.55±0.06)、对照组和治疗组MMP1蛋白表达量(0.59±0.06、1.45±0.03)低于模型组(1.95±0.04),差异有统计学意义(P<0.01),见图3、图4。
-
图3 各组大鼠阴茎组织TLR4、MAPK、MMP1蛋白相对表达量比较
-
图4 各组大鼠阴茎组织TLR4、MAPK、MMP1蛋白
-
3 讨论
-
PD对男性勃起功能的影响越来越受到学者的重视,目前PD全球发病率约为0.4%~3.5%,欧美国家40~60岁男性中PD的患病率为3%~9%[12],我国目前也处于上升趋势。Ralph等[13]研究显示PD可出现在男性的各个年龄段,其中55~60岁男性患病较多。Tal等[14]统计了10年间报道的1280例PD患者,结果显示,青年男性仅有32例,约2.5%。然而伴随勃起功能障碍(erectile dysfunction,ED)的PD患者约40%~60%[15]。本病目前治疗方法较多,包括药物治疗、外冲击波治疗、电离子渗入疗法、物理牵引、放射治疗及手术治疗等。药物治疗是目前临床医师的首选,目前常用药物为维生素E、秋水仙素、对氨基苯甲酸、己酮可可碱等,但多无确切疗效。
-
“阴茎硬结症”是现代医学名词,祖国医学尚无此记载,但是依据症状和病因病机与祖国医学“阴茎痰核”“阴茎疽”“玉茎结疽”相符。阴茎属前阴,“前阴者,宗筋之所聚,太阴阳明之所合”。肝气郁滞、脾胃虚弱、饮食不节,或外感寒湿等造成气机失调,脾失健运,浊痰内生,下注宗筋,皆可凝结而成痰核。故气滞痰凝、痰瘀互结为本病的基本病理变化,治疗当以活血通络、化痰散结为主。小金丸源于清·王洪绪《外科全生集》,《中国药典》将其改名为小金丸,以丸剂生产,主要由人工麝香、木鳖子、制草乌、枫香脂、乳香、没药、五灵脂、当归、地龙、香墨等药物组成。功效散结消肿、化瘀止痛为其功效[16]。国内有报道小金丸联合六味地黄丸和小金丸联合地塞米松治疗PD,且其疗效显著[4,16]。本课题组前期临床研究也证实小金丸能够明显改善PD大鼠阴茎海绵体纤维化,能够降低基质金属蛋白酶含量[6]。
-
PD的发病机制尚无明确阐述,多数学者认为与遗传因素和阴茎白膜受损后的炎症反应相关。阴茎受到外力后,出现阴茎海绵体白膜微损伤,局部出现炎症及氧化应激反应,氧自由基生成和肿瘤生长因子(TGF-β)释放[17],导致纤维化过程出现,瘢痕修复[18]。最常见的PD患者白膜炎症反应是性交时阴茎的创伤[19-20],继而出现成纤维细胞的增殖及分化肌成纤维细胞增多,最终导致过度细胞外基质的沉积[21-22]。与此同时,核因子-κB(NF-κB)激活,诱导一氧化氮活酶生成,导致NO增加,过量的纤维蛋白及胶原堆积,最终斑块硬结形成。TLR4是一种刺激包括MAPK和NF-κB通路在内的几种下游通路的受体,是NLRP3炎性小体通路的关键调节因子,NF-κB能够促进NLRP3等促炎细胞因子的合成,因此,NF-κB和MAPK信号通路的激活,参与了炎症和纤维化反应[23]。研究发现人参皂苷Rh2抑制肝癌HepG2细胞迁移能够通过激活MAPK通路抑制AP1转录因子,从而减少MMP3的表达[24]。在PD发病过程中,金属蛋白酶类(MMPs)和它的组织抑制剂(TIMPs)起了重要作用[25]。PD患者和白膜周围病变患者的白膜组织采用蛋白组学方法检测发现多种因子表达异常,即MMP1、8和13未在PD患者的白膜组织中检测到。然后在通过TGF-1和IL-1处理的成纤维细胞,体外培养,培养基中添加MMPs和TIMPs,可检测到MMP1、2、8、9、10和13的表达增加,结果提示在硬结形成之前及塑形阶段,成纤维细胞发挥重要作用,也可以作为PD的治疗靶点,为以后PD机制研究和治疗指明一个方向。TGF-β1受体的小分子抑制剂激活素受体样激酶5抑制,可以拮抗TGF-β信号通路,致使磷酸化的smad2和smad3含量增加,并增加smad蛋白由核外向核内转移,也可作为一种治疗PD的新靶点[26]。与PD密切相关的纤维化因子还有内皮素1、结缔组织生长因子、血管紧张素Ⅱ、血小板衍生生长因子等。
-
本研究证实,小金丸能过够调节TLR4、p38MAPK、MMP1表达从而治疗PD,即小金丸抑制TLR4因子表达,减少MAPK信号通路表达,从而抑制MMP1蛋白表达,抑制组织炎性反应和纤维化反应,最终能够抑制阴茎硬结形成。Gokce等[10]的研究显示,TGF-β1阴茎海绵体白膜内注射建立PD模型后,阴茎海绵体内MMP1/2/3/9较对照组明显增加,阴茎海绵体纤维化程度也较对照组明显,且勃起功能也受到影响。PD发病机制是纤维化与抗纤维化平衡状态被打乱,导致组纤维化因子表达增加,抗纤维化因子表达因子减少,最终导致纤维化,阴茎弯曲度增加。研究也证实上调TLR4表达,TLR4高表达会诱导p38MAPK信号通路的激活,进而导致下游的NLRP3炎性小体激活引起组织炎症和纤维化反应。
-
综上所述,PD发病机制与TLR-p38MAPK-MMP1介导的纤维化机制有关,通过调节炎性反应和纤维化反应,使阴茎海绵体纤维化,严重时致畸。小金丸治疗后能够显著增加TLR4-p38MAPK信号通路表达,从而减少MMP1表达抑制PD大鼠海绵体纤维化,表明小金丸治疗PD与抑制TLR-p38MAPK-MMP1抗纤维化机制有关。
-
参考文献
-
[1] Brock G,Hsu GL,Nunes L,et al.The anatomy of the tunica albuginea in the normal penis and Peyronie’s disease[J].J Urol,1997,157(1):276-281.
-
[2] Lischer GH,Nehra A.New advances in Peyronie’s disease[J].Curr Opin Urol,2001,11(6):631-636.
-
[3] 中华医学会男科学分会,阴茎硬结症诊断与治疗指南编写组.阴茎硬结症诊断与治疗指南[J].中华男科学杂志,2022,28(3):262-272.
-
[4] 杨顺利,杨立杰.小金丸口服配合药物注射治疗阴茎硬结症28例[J].中国药业,2016,25(4):123-125.
-
[5] 杨钰莹,尤晓舟,全云云,等.小金丸现代研究进展及制剂存在问题分析[J].中医药导报,2023,29(2):172-178.
-
[6] Geng Q,Wang F,Han Q,et al.Antioxidant mechanism of Xiaojin pill()for treatment of peyronie’s disease in rats based on matrix metalloproteinases[J].Chin J Integr Med,2019,25(9):671-676.
-
[7] Huang J,Liu J,Chang GJ,et al.Glutamine supplementation attenuates the inflammation caused by LPS-induced acute lung injury in mice by regulating the TLR4/MAPK signaling pathway[J].Inflammation,2021,44(6):2180-2192.
-
[8] Wu T,Shen MY,Guo XM,et al.Cyclocarya paliurus polysaccharide alleviates liver inflammation in mice via beneficial regulation of gut microbiota and TLR4/MAPK signaling pathways[J].Int J Biol Macromol,2020,160:164-174.
-
[9] Bivalacqua TJ,Diner EK,Novak TE,et al.A rat model of Peyronie’s disease associated with a decrease in erectile activity and an increase in inducible nitric oxide synthase protein expression[J].J Urol,2000,163(6):1992-1998.
-
[10] Gokce A,Abd Elmageed ZY,Lasker GF,et al.Adipose tissue-derived stem cell therapy for prevention and treatment of erectile dysfunction in a rat model of Peyronie’s disease[J].Andrology,2014,2(2):244-251.
-
[11] 王梦雅,石瑞.小金丸抗大鼠乳腺小叶增生的作用研究[J].临床合理用药杂志,2019,12(35):20-21.
-
[12] Müller A,Mulhall JP.Peyronie’s disease intervention trials:methodological challenges and issues[J].J Sex Med,2009,6(3):848-861.
-
[13] Ralph D,Gonzalez-Cadavid N,Mirone V,et al.The management of Peyronie’s disease:evidence-based 2010 guidelines[J].J Sex Med,2010,7(7):2359-2374.
-
[14] Tal R,Hall MS,Alex B,et al.Peyronie’s disease in teenagers[J].J Sex Med,2012,9(1):302-308.
-
[15] Lopez JA,Jarow JP.Penile vascular evaluation of men with Peyronie’s disease[J].J Urol,1993,149(1):53-55.
-
[16] 严丰,吉庆.小金丸合六味地黄丸治疗阴茎硬结症2例[J].湖南中医杂志,2009,25(5):83.
-
[17] Paulis G,Brancato T.Inflammatory mechanisms and oxidative stress in Peyronie’s disease:therapeutic “rationale” and related emerging treatment strategies[J].Inflamm Allergy Drug Targets,2012,11(1):48-57.
-
[18] Davila HH,Ferrini MG,Rajfer J,et al.Fibrin as an inducer of fibrosis in the tunica albuginea of the rat:a new animal model of Peyronie’s disease[J].BJU Int,2003,91(9):830-838.
-
[19] Jarow JP,Lowe FC.Penile trauma:an etiologic factor in Peyronie’s disease and erectile dysfunction[J].J Urol,1997,158(4):1388-1390.
-
[20] Devine CJ Jr,Somers KD,Jordan SG,et al.Proposal:trauma as the cause of the Peyronie’s lesion[J].J Urol,1997,157(1):285-290.
-
[21] Somers KD,Dawson DM,Wright GL Jr,et al.Cell culture of Peyronie’s disease plaque and normal penile tissue[J].J Urol,1982,127(3):585-588.
-
[22] Somers KD,Dawson DM.Fibrin deposition in Peyronie’s disease plaque[J].J Urol,1997,157(1):311-315.
-
[23] Shen XL,Guo YN,Lu MH,et al.Acetaminophen-induced hepatotoxicity predominantly via inhibiting Nrf2 antioxidative pathway and activating TLR4-NF-κB-MAPK inflammatory response in mice[J].Ecotoxicol Environ Saf,2023,252:114590.
-
[24] 冯子强,左国伟,石庆强,等.人参皂苷Rh2抑制肝癌HepG2细胞迁移的实验研究[J].中国免疫学杂志,2015,31(1):61-65.
-
[25] del Carlo M,Cole AA,Levine LA.Differential calcium independent regulation of matrix metalloproteinases and tissue inhibitors of matrix metalloproteinases by interleukin-1beta and transforming growth factor-beta in Peyronie’s plaque fibroblasts[J].J Urol,2008,179(6):2447-2455.
-
[26] Jang JH,Ryu JK,Suh JK.Activin receptor-like kinase 5 inhibitor attenuates fibrosis in fibroblasts derived from peyronie’s plaque[J].Korean J Urol,2012,53(1):44-49.
-
摘要
目的:研究小金丸对大鼠阴茎硬结症模型阴茎海绵体内TLR4、p38MAPK、MMP1的表达调节及对大鼠阴茎纤维化作用的可能机制。方法:将雄性SD大鼠18只随机分为3组:对照组、模型组、小金丸治疗组;对照组阴茎海绵体白膜下注射生理盐水,饲养6周后双蒸水灌胃;模型组、小金丸治疗组阴茎海绵体白膜下注TGF-1β(转化生长因子-1β),饲养6周后小金丸灌胃;模型组大鼠与小金丸治疗组等量水灌胃;3组灌胃处理4周后处死,留取大鼠阴茎组织。采用HE染色观察阴茎海绵体纤维化程度;PCR和WB检测TLR4-p38MAPK-MMP1通路RNA和蛋白表达情况。结果:病理组织学HE染色发现,模型组比对照组纤维化明显加;小金丸治疗组与模型组相比纤维化明显减少。对照组和小金丸治疗组的TLR4-p38MAPK-MMP1 RNA表达量及TLR4-p38MAPK-MMP1的蛋白表达明显低于模型组,差异有统计学意义(P<0.01)。结论:阴茎硬结症大鼠模型阴茎海绵体内纤维化明显,TLR4-p38MAPK -MMP1表达增加;小金丸治疗后,纤维化明显改善,TLR4-p38MAPK-MMP1表达减少。小金丸治疗阴茎硬结症抑制纤维化与TLR4-p38MAPK-MMP1介导的抗纤维化作用有关。
Abstract
Objective To evaluate the effects and mechanism of Xiaojin pills for the treatment of a rat model of PD, and to research the level of TLR4-p38MAPK-MMP1 in the corpora cavernosa. Methods Twenty-four male Sprague-Dawley rats (400–450 g) were randomly divided into three groups: sham, PD and PD plus Xiaojin pills treatment. All rats underwent penile injections into the TA with 50 μL vehicle (sham) or transforming growth factor (TGF)-β1 (50 μg/rats) injected into the TA (remaining groups). The PD group was gavaged 50 μL water twice one day on the 42 days after TGF-b1 injection. The PD plus Xiaojin pills treatment group was gavaged 50 μL solution (50 μg xiaojin pills) twice one day on the 42 days after TGF-1β injection). Twenty-eight days following Intragastricing, the penile tissues of all rats were harvested and stored at 80 ℃ for further analysis. Tissues were evaluated histologically and for expression of TLR4-p38MAPK-MMP1. Statistical analysis was performed by analysis of variance followed by the Tukey test for post hoc comparisons. Results Pathological HE staining showed that the model group had more obvious fibrosis than the control group. The fibrosis of Xiaojin pill treatment group was significantly improved compared with model group. The expression of TLR4-p38MAPK-MMP1 RNA in control group and Xiaojin pill treatment group was significantly lower than that in model group (P<0.01). The expression of TLR4-p38MAPK-MMP1 protein in control group and Xiaojin pill treatment group was significantly lower than that of model group (P<0.01). Conclusions There was obvious fibrosis and increased expression of TLR4-p38MAPK-MMP1 in penile sponges of rats with penile sclerosis. After Xiaojin pill treatment, the fibrosis was significantly improved and the expression of TLR4-p38MAPK-MMP1 was reduced. The treatment of penile sclerosis with Xiaojin pills may be related to the anti-fibrosis mechanism mediated by TLR4- p38MAPK-MMP1.
关键词
阴茎硬结症 ; 小金丸 ; TLR4-p38MAPK-MMP1信号通路 ; 大鼠 ; 抗纤维化
Keywords
Peyronie's disease ; Xiaojin pills ; TLR4- p38MAPK-MMP1 signal path ; rat ; antifibrosis