-
肾透明细胞癌是泌尿系统最常见的恶性肿瘤之一,据统计,肾透明细胞癌的发病率在男性排第6位,女性排第9位,根据美国癌症流行病学统计,2021年全球大约有76 080例新发肾透明细胞癌患者[1]。在全部新确诊的肾透明细胞癌病例中,男性的人数是女性的2倍。因肾透明细胞癌导致的死亡病例约为13 780例,男性是女性的2倍[2]。随着现代影像诊疗技术和微创外科技术在肾透明细胞癌诊断及治疗领域的快速发展与应用,极大地改善了肾癌的治愈率与生存率。然而,目前尚缺乏可用于肾癌早期诊断与预测肿瘤浸润、转移与预后的敏感的生物学标志物,导致大部分肾癌患者在初次确诊时,肿瘤就已经被诊断为局部晚期,其肿瘤侵润、转移的恶性生物学行为是导致肾癌患者死亡的主要原因。这提示,肾癌早期诊断、早期治疗是提高患者治愈率,无瘤生存率及生活质量的关键策略。鉴于此,本研究采用多种分子生物学技术,从多角度对微小染色体维持蛋白复合物6(minichromosome maintenance complex component 6,MCM6)、细胞分裂周期相关蛋白6(cell division cycle6,CDC6)在肾透明细胞癌组织中的表达与恶性生物学行进行了比较研究,以验证MCM6、CDC6能否作为肾透明细胞癌一种潜在的生物学标志物。
-
1 资料和方法
-
1.1 一般资料
-
纳入2021年1月—2023年12月就诊于天津市南开医院泌尿外科的77例肾透明细胞癌患者,纳入标准为不伴有远端转移、无手术治疗禁忌证的肾透明细胞癌,且在手术后均得到了明确的病理诊断。排除术前已接受放化疗的患者。采集77例患者的癌组织及癌旁组织样本。本研究经过患者的知情同意。
-
1.2 实验材料及仪器
-
兔抗人MCM6抗体(ab184147)、兔抗人CDC6抗体(ab109315)、羊抗兔二抗(ab6702)、β-action(ab179467)均购自英国Abcam公司,Lipofectamine3000 转染试剂(L3000008)、胎牛血清(A5669701)、第一链cDNA合成试剂盒(K1621),FastStart Universal SYBR Green预混液(4385612)、生物安全柜、微孔板检测器、ABI PRISM 7900HT序列检测系统均购自美国Thermo Fisher公司,蛋白 Marker(P0068)、胰酶细胞消化液(C0201)、苏木素伊红(HE)染色试剂盒(C0105S)、TRIzol试剂(R0016)、PVDF膜(FFP39)购自中国碧云天生物技术股份有限公司,青霉素-链霉素溶液(PB180120,中国赛维尔生物科技有限公司),实验仪器:超净工作台(美国Airtech 公司),冷冻高速离心机、手动单通道移液枪(德国 Eppendorf 公司),电子天平(德国Sartorius公司),普通光学倒置显微镜(日本Olympus公司),转膜仪、电泳仪电源(美国Bio-Rad公司)
-
1.3 细胞与培养
-
肾透明细胞癌HTB-47和CRL-1932细胞购自美国模式培养物集存库(ATCC),两种细胞均用含10%FBS和1%青霉素-链霉素双抗的1640培养液培养,培养箱环境设定为37℃与5%CO2的湿润空气环境。
-
1.4 数据提取
-
从GEPIA数据库(http://gepia.cancer-pku.cn/detail.php?gene=MCM6)中提取MCM6在肾透明细胞癌中的表达和无病生存率。MCM6在其他癌症中的表达则来自The Human Protein Atlas在线数据库(https://www.proteinatlas.org/ENSG00000076003-MCM6/tissue)。CDC6在肾透明细胞癌中的表达以及MCM6和CDC6之间的相关性来自数据库(http://gepia.cancer-pku.cn/detail.php?gene=CDC6)。通过The Human Protein Atlas在线数据(https://www.proteinatlas.org/ENSG00000094804-CDC6/tissue)分析CDC6在各种癌症中的表达。通过The Human Protein Atlas在线数据库获得了人肾透明细胞癌组织中MCM6 (https://www.proteinatlas.org/ENSG00000076003-MCM6)和CDC6(https://www.proteinatlas.org/ENSG00000094804-CDC6)蛋白的表达情况。
-
1.5 细胞转染
-
HTB-47和CRL-1932细胞种植于24孔板培养1 d后,使用shRNA(序列AAGTGCCAGAAACTGTTCCTGGA)进行转染,转染试剂为Lipofectamine3000。使用50 μL Lipofectamine3000滴加入24孔板中并混合均匀,继续培养48 h。
-
1.6 提取RNA和qRT-PCR
-
使用Trizol试剂从HTB-47和CRL-1932细胞中提取总RNA。用第一链cDNA合成试剂盒合成cDNA。使用ABI 7900HT qPCR循环和FastStart Universal SYBR Green master预混液进行qRT-PCR实验。
-
1.7 Western blot实验检测相关蛋白表达水平
-
弃掉HTB-47和CRL-1932细胞培养液并用PBS冲洗,加入裂解液后低温吹打,15 min后在4℃的环境下使用12 000 r/min的转速下在离心机内离心EP管15 min,离心静置后取上清液。将获得的小鼠肾脏蛋白提取液使用PBS进行稀释,将每个样品的蛋白浓度调整至基本相同。在每个胶孔中按顺序加入10 μL蛋白样品,在电泳胶最外侧的胶孔中加入3.5 μL蛋白Marker以及6.5 μL蛋白上样缓冲液。将电泳仪连接到电泳电源中,检查无误后接通电源,设定恒定电压,在溴酚兰条带靠近分离胶的底部边缘处切断电源,停止电泳。将转膜液预先放置在冰箱中进行预冷,并按照目标蛋白质的分子量对PVDF薄膜进行切割,然后在甲醇中活化。将胶状物铲出,并按“黑胶白膜”的原理,将胶片与PVDF薄膜分别固定于黑白夹套中,再往外依次放入转膜滤纸、海绵片。将薄膜测量仪与直流电源相连,置于恒定电流工作状态,将电流设定为250 mA,并设定转换时间为90 min。当电转完成之后,用镊子将PVDF薄膜取下,放入事先准备好的5%脱脂奶粉溶液中在室温环境下于摇床上缓慢地封闭2 h,再用TBST冲洗3次,每次5 min。按照目标蛋白质的分子量来切割PVDF薄膜,按照抗体说明,用1%BSA对一抗进行稀释。用一抗稀释溶液浸泡切割后的PVDF薄膜,在4℃环境温度下摇床孵育过夜,过夜时间保存12 h。一抗完成孵育后,用 TBST冲洗5 min,冲洗3次,之后将其放入配制好的二抗稀释液中,在室温下摇床孵育进行2~3 h,孵育完成后再次使用TBST冲洗5 min,冲洗3次。提前配制好显影溶液,置于避光处,将PVDF薄膜浸入显影溶液10~20 s。使用Bio-Rad化学发光成象仪对得到的PVDF薄膜进行扫描。
-
1.8 克隆形成实验检测细胞增殖能力
-
用胰酶将转染了MCM6 shRNA的HTB-47和CRL-1932细胞重悬稀释后,以每孔3×103个的数量放入6孔板中,于37℃、5% CO2的湿润空气环境中培养2周,于此期间每4天更换培养液并进行观察,2周后每孔用1.5 mL 4%多聚甲醛固定15 min,并用0.2%结晶紫染色10 min,之后使用PBS冲洗干净后晾干拍照。
-
1.9 CCK-8实验检测细胞增殖情况
-
将转染MCM6 shRNA的HTB-47和CRL-1932细胞按照上述步骤重悬并以每孔2000个细胞的数量放入96孔板中培养5 d后,加入10% CCK-8试剂4 h,并在570 nm波长下检测吸光度。
-
1.10 免疫组化染色检测MCM6、CDC6蛋白的表达水平
-
石蜡标本切片,厚度5 μm,65℃烘烤45 min脱蜡,之后依次浸泡在二甲苯(1)10 min、二甲苯(2)10 min、100% 乙醇(1)5 min、100% 乙醇(2)5 min、95% 乙醇5 min、85% 乙醇5 min、75% 乙醇5 min。随后,在PBS缓冲液中冲洗 2 min,共冲洗3次。将冲洗后的切片放入柠檬酸缓冲液中,在微波炉中还原抗原(先大火5 min,然后中火10 min)取出后在室温下冷却约2 h,用PBS缓冲液清洗3次,每次 2 min。晾干去除多余水分后,在湿盒中滴入H2O2浸泡 15 min,再用PBS缓冲液清洗3次,每次 2 min,沥干多余水分并滴入抗体,在 4℃过夜。第2天,将湿盒置于室温下恢复正常温度,用PBS缓冲液清洗3次,每次2 min,然后滴加二抗反应2 h。再用 PBS 缓冲液洗1次,滴入DAB(预先配好),在室温下染色约15~20 s后停染,再用苏木精染细胞核5~8 s,用蒸馏水冲洗2 min。之后依次浸泡于75%酒精、85%酒精、95%酒精各10 s,100%乙醇(1)、100%乙醇(2)各5 min,二甲苯(1)、二甲苯(2)各5 min。最后,使用中性树脂封胶,在显微镜下观察。免疫组化结果判定: 2名病理医师双盲法状态下,高倍镜(×200)观察肿瘤细胞,出现明显染色颗粒判为阳性细胞。染色程度评分规则:无染色,0分;轻微染色,1分;中等染色,2分;强染色,3分。染色细胞所占比例评分:无染色,0分;染色面积<25%,1分;染色面积26%~50%,2分;染色面积51%~75%,3分;染色面积>75%,4分。最终评分为染色强度与染色面积的乘积,随后根据评分进行分组:≥4分为高表达组,<4为低表达组。
-
1.11 统计学分析
-
本研究使用Graphpad Prism 8.0软件分析数据,并用t检验比较两组的差异,用χ2分析MCM6表达与肾透明细胞癌临床病理参数之间的相关性,以及MCM6与CDC6之间的关系。P<0.05为差异有统计学意义。
-
2 结果
-
2.1 肾透明细胞癌中MCM6表达上调且与预后相关
-
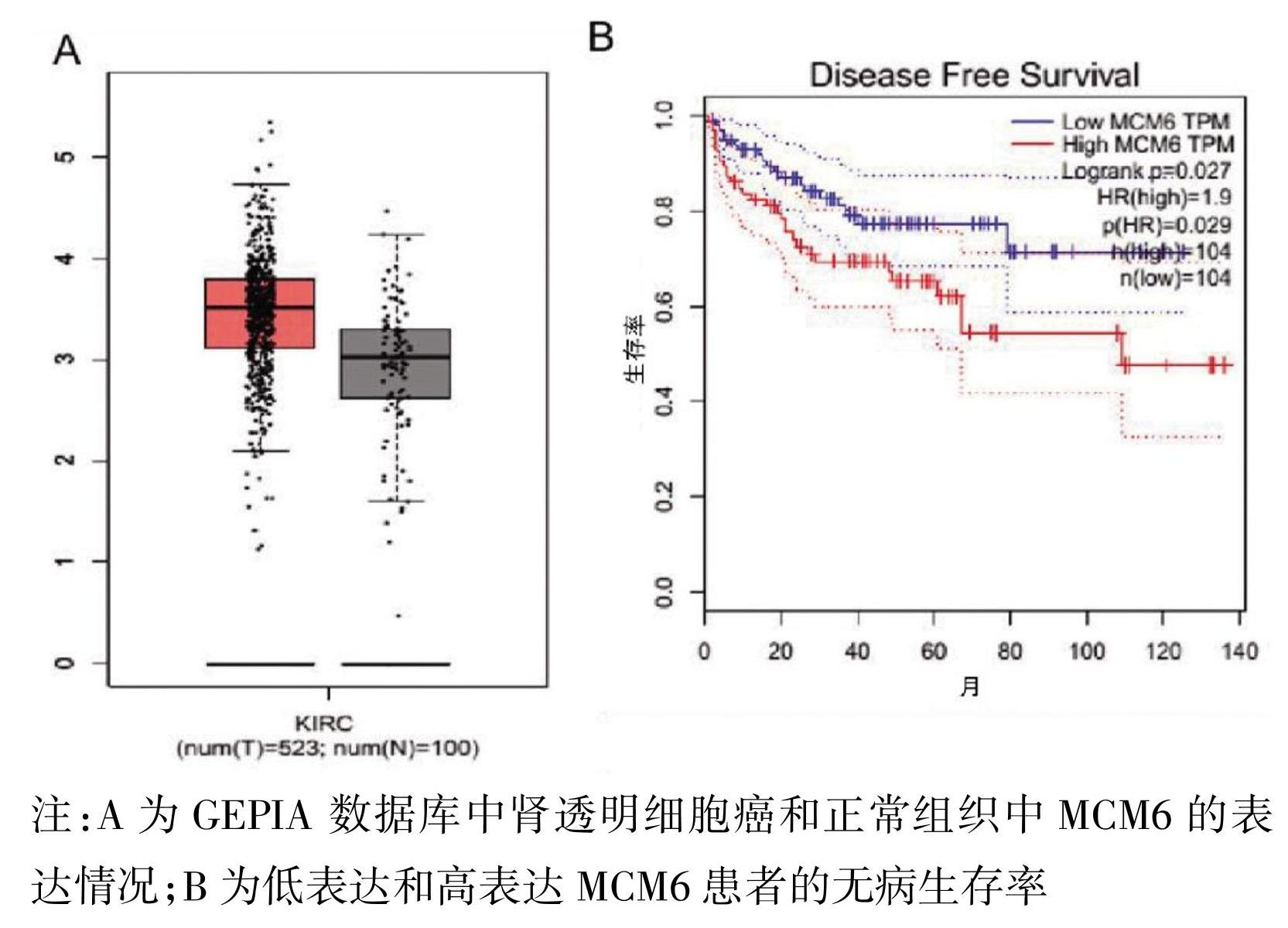
本研究首先基于GEPIA数据库分析了623份临床样本(包括523份肾透明细胞癌组织和100份癌旁正常组织)的MCM6表达情况。结果表明,与癌旁正常组织相比,MCM6在肾透明细胞癌中的表达明显升高(图1A),MCM6的表达与肾透明细胞癌的无病生存率密切相关(图1B)。
-
图1 MCM6的表达水平与肾透明细胞癌患者的不良预后呈正相关
-
2.2 MCM6预测肾透明细胞癌的临床预后
-
本研究收集的77例肾透明细胞癌组织中,MCM6的表达明显上调(图2)。本研究根据77例肾透明细胞癌样本MCM6表达的染色强度,将其分为低表达组35例,高表达组42例,结果表明,MCM6的表达与肿瘤大小密切相关(P=0.010),但与年龄、性别和肿瘤分级无关(P>0.05,表1)。
-
图2 不同肾透明细胞癌组织样本MCM6的表达
-
2.3 MCM6促进肾透明细胞癌的增殖作用
-
qRT-PCR和Western-blot检测结果显示:1)对照组相比,MCM6 shRNA组的MCM6 mRNA和蛋白表达明显受到抑制(图3A-3B);2)敲低 HTB-47和CRL-1932细胞MCM6 可抑制HTB-47和CRL-1932细胞的克隆形成能力,验证了MCM6表达上调能明显促进的促肾透明细胞癌的细胞的增殖作用(图4A);3)CCK-8检测结果显示,敲低MCM6能显著抑制肾透明细胞癌的增殖能力(图4B);4)细胞周期结果显示,敲低MCM6可显著阻滞HTB-47和CRL-1932细胞的细胞周期停滞在G2/M期(图4C)。
-
图3 在体外细胞系中敲低MCM6后mRNA和蛋白的表达
-
2.4 数据库CDC6与MCM6相关性研究
-
通过在线数据库分析证实,MCM6与CDC6之间在肿瘤细胞间的生物学调节作用密切相关(R=0.75,P<0.01,图5A),并发现CDC6与MCM6在空间和功能上紧密关联(图5B)。通过GEPIA在线数据库的相关信息分析,证实CDC6在肾透明细胞癌中的表达明显高于癌旁正常组织(图5C)。
-
图4 敲低MCM6对细胞增殖和周期的影响
-
图5 MCM6与CDC6在癌症中关系密切
-
2.5 MCM6和CDC6之间的相关性研究
-
根据人类蛋白质图谱数据库发现,MCM6的表达与CDC6的表达呈正相关(图6A)。本研究通过对77例肾透明细胞癌组织进行免疫组化染色,以分析MCM6表达与CDC6表达的相关性,既肾透明细胞癌患者CDC6与MCM6均为高水平表达(图6B);相关分析结果显示,CDC6与MCM6表达水平呈显著相关性(χ2=11.126,P=0.001,r=0.388,表2)。
-
3 讨论
-
肾透明细胞癌是泌尿系统最常见的恶性肿瘤,其发病率呈逐年增高的趋势,大部分肾癌患者初次就诊时多以肉眼血尿就医,其肾癌的病理组织学分期已进展为局部晚期,众所周知,肾癌的恶性生物学行侵袭和转移是威胁患者生命和导致死亡的主要原因[3]。随着现代分子生物学技术的应用于快速发展,研究与探索能够早期预测肾癌诊断与肿瘤临床进展的相关的生物标志物,已成为基础与临床研究的重要课题[4]。
-
图6 通过免疫组化染色观察 MCM6 和 CDC6 之间的相关性
-
有研究显示,MCM6的胞内作用失调可促进多种肿瘤的发生发展[5]。在乳腺癌的研究中发现,通过抑制MCM6的方式干扰MEK/ERK信号通路后可观察到三阴性乳腺癌的侵袭能力下降[6]。而在结肠癌、肝细胞癌与胰腺癌的研究中,研究人员均观察到MCM6的表达上调,而这一表达上调与患者的不良预后相关[7-9]。因此,有学者认为MCM6可能成为早期发现肿瘤的生物标志物和治疗肿瘤的潜在靶标[10]。
-
与MCM6相类似,CDC6的异常高表达也被证实与多种肿瘤的发生发展有关。先前有报道称CDC6可促进乳腺癌细胞的增殖,而在多形性胶质母细胞瘤的研究中发现,CDC6的表达上调通常与患者预后不良呈正相关[11]。类似的研究结论也出现在了前列腺癌的研究中,该研究声称可以通过靶向抑制CDC6来控制前列腺癌的增殖和转移[12]。在研究非小细胞肺癌后发现,CDC6也会在该类肺癌中出现高表达[13],且有研究者认为CDC6可成为该类肺癌患者早期诊断的生物标志物[14],并可能为治疗非小细胞肺癌提供新思路[15]。CCD6的作用如此关键且丰富,但 CDC6在肾透明细胞癌中的作用尚不清楚,是否与MCM6共同参与肾透明细胞癌的发生发展亦不明晰,故而本研究尝试初步验证肾透明细胞癌与MCM6和CDC6的关系。
-
首先,本研究利用GEPIA 数据库对MCM6在肾透明细胞癌中的表达进行分析,其结果显示MCM6在肾透明细胞癌中表达显著上调,且与无病生存率相关。随后,本研究将纳入研究的77例患者的肾透明细胞癌组织及癌旁正常组织进行免疫组化染色,染色结果同样表明MCM6在肾透明细胞癌中高表达。接着,本研究探讨MCM6与常见临床病理参数的关系,分析后发现MCM6的高表达与肿瘤大小相关(P=0.01),但与年龄、性别和肿瘤分级无关(P>0.05)。在此基础上,本研究使用MCM6 shRNA 转染肾透明细胞癌HTB-47和CRL-1932细胞,在确认转染成功后依次进行Western 印迹、克隆形成、CCK-8试验,试验结果均表明,敲低MCM6可抑制HTB-47和CRL-1932细胞的增殖,这意味着MCM6在肿瘤的发生和发展过程中起着关键作用。
-
同时,本研究也就CDC6与MCM6的关系进行探讨。根据在线数据库分析结果显示,CDC6与MCM6存在密切关系,且CDC6同样在肾透明细胞癌中表达上调。为验证MCM6与CDC6相互作用的假设,本研究将77 例配对组织进行免疫组织化学染色检测,以观察MCM6和CDC6的表达,其结果显示MCM6高表达的患者同时存在CDC6的高表达。因此,MCM6/CDC6 复合物可能为肾透明细胞癌患者的治疗提供一种潜在的治疗策略。
-
总之,本研究认为MCM6和CDC6在肾透明细胞癌中表达上调,并与患者的不良预后有关,且MCM6与CDC6相互作用密切,而MCM6/CDC6可能成为诊断肾透明细胞癌的潜在生物标记物和一个新的治疗靶点。然而,该结论还需要进一步验证和巩固。单中心和小样本的特点是本研究的局限所在,所以需要进行更多的体内和体外机制实验来进一步巩固上述结论。本研究下一步的研究目标是深入探讨MCM6和CDC6与肾透明细胞癌的具体关系,以期为肾透明细胞癌的早期诊断和治疗做出贡献。
-
参考文献
-
[1] Siegel RL,Miller KD,Fuchs HE,et al.Cancer statistics,2021 [J].CA Cancer J Clin,2021,71(1):7-33.
-
[2] Leite LM,Bergerot PG,Dettino ALA,et al.Influence of treatment access on survival of metastatic renal cell carcinoma in Brazilian cancer center[J].Int Braz J Urol,2021,47(3):566-573.
-
[3] Zhang J,Wang LL,Xie X.RFC4 promotes the progression and growth of Oral Tongue squamous cell carcinoma in vivo and vitro[J].J Clin Lab Anal,2021,35(5):e23761.
-
[4] Park CK,Heo J,Ham WS,et al.Ferroportin and FBXL5 as prognostic markers in advanced stage clear cell renal cell carcinoma[J].Cancer Res Treat,2021,53(4):1174-1183.
-
[5] Guerrero-Puigdevall M,Fernandez-Fuentes N,Frigola J.Stabilisation of half MCM ring by Cdt1 during DNA insertion[J].Nat Commun,2021,12(1):1746.
-
[6] Shao GL,Fan XL,Zhang PS,et al.Methylation-dependent MCM6 repression induced by LINC00472 inhibits triple-negative breast cancer metastasis by disturbing the MEK/ERK signaling pathway[J].Aging,2021,13(4):4962-4975.
-
[7] Jang NR,Baek J,Ko Y,et al.High MCM6 expression as a potential prognostic marker in clear-cell renal cell carcinoma[J].In Vivo,2021,35(1):299-306.
-
[8] Chen WG,Gao C,Liu Y,et al.Bioinformatics analysis of prognostic miRNA signature and potential critical genes in colon cancer[J].Front Genet,2020,11:478.
-
[9] Wang LH,Zhou LS,Hou J,et al.Three novel circRNAs upregulated in tissue and plasma from hepatocellular carcinoma patients and their regulatory network[J].Cancer Cell Int,2021,21(1):72.
-
[10] Zeng T,Guan Y,Li YK,et al.The DNA replication regulator MCM6:an emerging cancer biomarker and target[J].Clin Chim Acta,2021,517:92-98.
-
[11] Bömer M,Pérez-Salamó I,Florance HV,et al.Jasmonates induce Arabidopsis bioactivities selectively inhibiting the growth of breast cancer cells through CDC6 and mTOR[J].New Phytol,2021,229(4):2120-2134.
-
[12] Li H,Xu WR,Wang T,et al.MiR-26a inhibits the proliferation and migration of prostate cancer by targeting CDC6[J].Minerva Med,2021,112(5):661-663.
-
[13] Zhang XD,Lian T,Fan WJ,et al.Long-noncoding RNA CASC9 promotes progression of non-small cell lung cancer by promoting the expression of CDC6 through binding to HuR[J].Cancer Manag Res,2020,12:9033-9043.
-
[14] An C,Liu GJ,Cheng S,et al.A pilot study of cdc6 as a biomarker for circulating tumor cells in patients with lung cancer[J].J Clin Lab Anal,2020,34(6):e23245.
-
[15] Kyei Barffour I,Acheampong DO.Prospect of reprogramming replication licensing for cancer drug development [J].Biomed Pharmacother,2021,136:111190.
-
摘要
目的:探讨微小染色体维持蛋白复合物6、细胞分裂周期相关蛋白6在肾透明细胞癌组织中的表达与恶性生物学行为的相关性。方法:2021年1月—2023年12月就诊于天津市南开医院泌尿外科的77例肾透明细胞癌患者,选取其癌组织作为研究组,同源远侧的正常肾组织为对照组;基于GEPIA数据库MCM6和CDC6相关信息,应用单克隆抗体免疫组化技术比较研究MCM6和CDC6在肾透明细胞癌组织和正常组织中的表达;采用qRT-PCR和Western blot检测shRNA对MCM6表达的影响:应用CCK8和集落形成试验检测HTB-47和CRL-1932细胞系的体外增殖结果。结果:与正常肾组织相比,MCM6/CDC6在肾透明细胞癌组织中明显上调,且MCM6上调与无病生存率降低相关(P<0.05);敲低HTB-47和CRL-1932细胞系的MCM6基因可显著抑制肿瘤细胞的增殖,并显著阻滞了肿瘤细胞分裂周期停留在G2/M期;MCM6的表达与肾癌体积大小显著相关(P=0.010),并根据GEPIA数据库显示,CDC6与MCM6有明显的相关性(P<0.01),所有表达结果均通过免疫组化染色检测进一步验证。结论:MCM6的表达上调与肾透明细胞癌的恶性行为和临床进展有关,其可通过影响细胞周期来调控细胞增殖,而在肾透明细胞癌组织中MCM6和CDC6表达量均显著上调且关系密切,表明MCM6/CDC6可能成为预测肾透明细胞癌的潜在生物标记物,并可能成为该病靶向治疗一个新的治疗靶点。
Abstract
Objective To explore the correlation between the expression of MCM6, CDC6 and malignant biological behavior in renal clear cell carcinoma tissues. Methods 77cases of renal clear cell carcinoma tissue confirmed by pathology were used as the study group, and homologous distal normal renal tissue was used as the control group for the MCM6. CDC6 study; Based on the GEPIA database, the expression of MCM6 and CDC6 in renal clear cell carcinoma tissue and normal tissue was compared using monoclonal antibody immunohistochemistry technology; qRT-PCR and Western blot were used to detect the effect of shRNA on MCM6 expression: CCK8 and colony formation assay were used to detect the in vitro proliferation results ofHTB-47 and CRL-1932 cell lines. Results Compared with normal renal tissue, MCM6, CDC6 was significantly upregulated in renal clear cell carcinoma tissue, and upregulation of MCM6 was associated with reduced disease-free survival rate (P<0.05); Knocking down the MCM6 gene of HTB-47 and CRL-1932 cell lines can significantly inhibit the proliferation of tumor cells and significantly block the tumor cell division cycle staying in the G2/M phase; The expression of MCM6 was significantly correlated with the volume size of renal cell carcinoma (P=0.010), and according to the GEPIA database, there was a significant correlation between CDC6 and MCM6 (P<0.01). All expression results were further validated by immunohistochemical staining. Conclusion The upregulation of MCM6 expression is related to the malignant behavior and clinical progression of renal clear cell carcinoma, which can regulate cell proliferation by affecting the cell cycle. In renal clear cell carcinoma tissues, the expression levels of MCM6 and CDC6 are significantly upregulated and closely related, indicating that MCM6/CDC6 may become a potential biomarker for predicting renal clear cell carcinoma and a new therapeutic target for targeted therapy of this disease.
关键词
微小染色体维持蛋白复合物6 ; 细胞分裂周期相关蛋白6 ; 肾透明细胞癌 ; 生物标记物