-
勃起功能障碍(erectile dysfunction,ED)被定义为无法(偶尔或经常性)获得并维持足够勃起以进行令人满意的性生活[1]。预计到2025年将有3.22亿男性受ED困扰[2]。有研究成果揭示了炎症与ED之间的关系,例如血清超敏C反应蛋白被视为预测ED风险的新的生物标志物[3]。由炎症引发的阴茎海绵体组织内血管内皮细胞(cavernosal endothelial cells,ECS)功能失调也可能导致ED的发生[4]。阴茎海绵体中的平滑肌细胞(corpus cavernosum smooth muscle cells,CCSMCs)可以主动调节勃起过程中海绵体血流灌注,亦是勃起的效应细胞,其结构和功能完整性是实现有效勃起的必要条件,但目前探讨CCSMCs炎症对ED的研究则很少[5]。番茄红素具有强大的抗炎作用,被报道可改善多种疾病中的炎症反应[6-7]。因此,本研究观察应用缺氧诱导SD大鼠CCSMCs内炎症反应及番茄红素干预的效果。
-
1 资料与方法
-
1.1 试剂与动物
-
DMEM/F-12培养液(Gibco公司),胎牛血清(Natocor公司),胰酶蛋白(杭州禾惠公司),CCK8试剂盒(杭州正伯公司),胶原酶I(Sigma公司),抗TNF-α抗体、抗IL-6抗体、抗α-SMA抗体(Abcam公司),抗IL-1β抗体、抗IL-18抗体(CST),HPR标记抗兔二抗、HPR标记抗鼠二抗(上海碧云天公司)、RT-qPCR试剂盒及其引物(中国AG公司)、番茄红素(上海耐澄公司)。雄性SD大鼠[体质量(250±10)g,年龄3个月]购自上海斯莱克实验动物有限公司[许可证号:SCXK(上海)2022-0004],饲养和照顾于浙江中医药大学实验动物中心[许可证号:SYXK(浙江)2021-0012]。
-
1.2 CCSMCs提取培养及CoCl2和番茄红素浓度筛选
-
CCSMCs制备方法参阅文献[8-9]。将2×103个CCSMCs接种于96孔板,24 h后用不同浓度CoCl2和番茄红素继续干预24 h,使用CCK8法检测细胞活力,筛选合适的CoCl2和番茄红素的浓度。随后将2×104个CCSMCs铺于6孔板,并分成对照组、缺氧组(CoCl2 200 μmol/L)和番茄红素治疗组(40 μmol/L),待细胞生长至80%后,使用200 μmol/L CoCl2和40 μmol/L 番茄红素干预24 h后提取总蛋白和总RNA。
-
1.3 免疫荧光染色
-
取对数生长期的 CCSMCs,用 0.25%胰酶蛋白处理后,铺于的 6 孔板中,每孔约 2×104 个细胞。培养至细胞融合度达到 60%~70%时,弃去培养基,用预冷的 PBS 清洗细胞 2 次,5 min/次。然后加入 4%多聚甲醛固定细胞 10 min,再次用 PBS 清洗 3 次。加入 0.3% Triton X-100 渗透处理 10 min,用 PBS 清洗 3 次,5 min/次。加入 5%牛血清白蛋白封闭 60 min,弃去封闭液,滴加兔抗α-SMA 和 Desmin 一抗(1:100),4℃孵育过夜。次日,用 PBS 清洗 3 次,5 min/次,然后滴加荧光标记的二抗(1:200),室温下孵育 1 h。最后用 PBS 清洗 3 次,5 min/次,用荧光显微镜观察并拍照记录结果。
-
1.4 蛋白免疫印迹法(Western blotting)检测 TNF-α、 IL-1β、IL-6、IL-18 蛋白表达水平
-
提取 CCSMCs 中总蛋白,使用 8%~12%SDS-PAGE 分离并转移到 PVDF 膜上。使用的 Tris 缓冲溶液(5%牛血清白蛋白),在室温(25~30℃)条件下进行 1 h 的封闭处理。随后在 4 益下与抗 IL-18(1:1000)、抗 IL-6(1: 600)、抗 TNF-α(1:1000)、抗β-actin(1:1000)和抗 IL-1β(1:1000)过夜孵育。然后与对应鼠、兔二抗室温下孵育 1 h。使用 FluorChem R 捕获图像及 Image J 软件分析结果。
-
1.5 定量逆转录聚合酶链反应(RT-qPCR)检测 TNF-α、IL-1β、IL-6、IL-18 基因表达水平
-
应用 Trizol 法提取 CCSCMs 中总 RNA,借助 Oligo 程序设计的引物由 Sangon Biotech 公司提供,进一步通过 RT-qPCR 进行定量检测。目标基因的表达水平以其与β-actin 基因的相对比值来评估,引物序列详情见表1。
-
1.6 统计学分析
-
所有数据均使用 GraphPad Prism 9.5 版本软件完成统计分析与图形展示。各组数据均采用 表示,组间差异使用单因素方差分析,进一步组间两两比较采用 LSD-t检验。 P<0.05 为差异有统计学意义。
-
2 结果
-
2.1 CCSMCs分离培养与鉴定
-
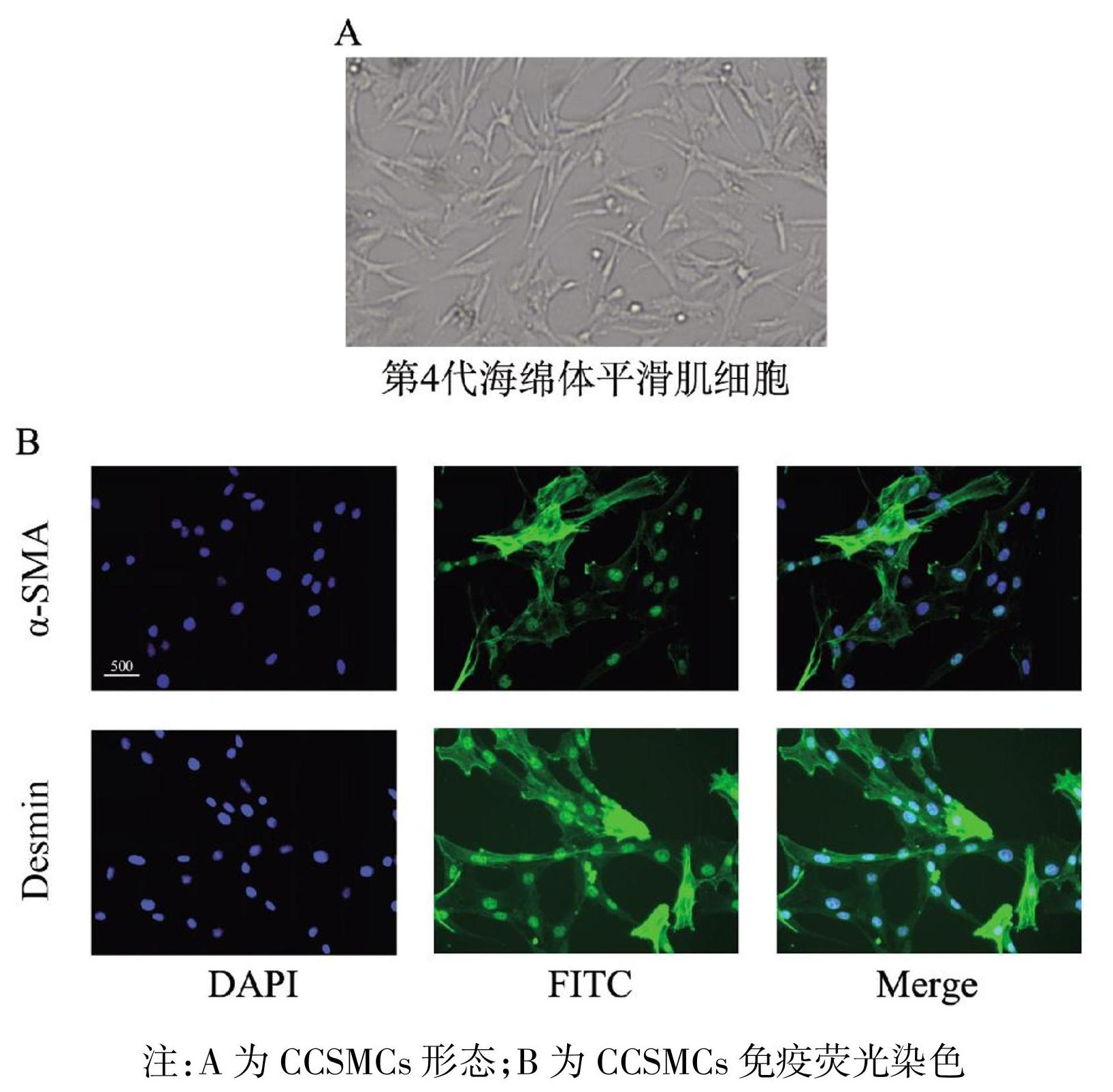
提取的细胞为典型纺锤状,并经4代培养后仍保持形态不变(图1A)。细胞在经过α-SMA和Desmin免疫荧光染色处理之后,呈现出了染色阳性的结果(图1B)。
-
图1 CCSMCs 细胞鉴定
-
2.2 CoCl2 和番茄红素浓度筛选
-
CCK8 实验结果显示,200 μmol/LCoCl2 能使 CCSMCs 细胞活性降低至正常组的 50%(图2A)。但 40 μmol/L 的番茄红素处理则提升了 CCSMCs 的细胞活性(图2B)。因此,本研究选用 200 μmol/L CoCl2 构建细胞缺氧模型和 40 μmol/L 番茄红素作为后续实验的处理浓度。
-
2.3 缺氧环境下 CCSMCs 内炎症因子表达情况及番茄红素的干预作用
-
Western blotting 显示,200 μmol/L CoCl2 干预 CCSMCs 后,HIF-1α蛋白表达含量升高,而 40 μmol/L 的番茄红素可使 HIF-1α蛋白表达显著下降 (图3A、3B)。随后对 CoCl2 组 CCSMCs 内炎症因子的蛋白和基因表达量进行检测,Western blotting 分析显示,CoCl2 组的 TNF-α、IL-6 和 IL-18 蛋白水平较正常对照组显著升高 (P<0.05),IL-1β仅有升高趋势,40 μmol/L 的番茄红素治疗后,TNF-α、IL-18 显著降低(P<0.05),IL6 和 IL-18 仅有降低趋势而无统计学意义(图3C、 3D)。RT-qPCR 分析显示,CoCl2 组中的 TNF-α、IL6、IL-1β和 IL-18 的 mRNA 表达水平相较于正常组显著升高 (P<0.05),40 μmol/L 的番茄红素治疗后,TNF-α、IL-1β和 IL-18 的 mRNA 表达水平显著降低(P<0.05),而 IL-6 仅有降低趋势而无统计学差异(图3E)。
-
图2 CoCl2 和番茄红素浓度筛选
-
3 讨论
-
长期的缺氧状态可触发海绵体组织内低度炎症反应,从而导致 ED 的发生[10]。CCSMCs 占海绵体细胞总数的 40%~50%,阴茎的正常勃起有赖于结构和功能完整的 CCSMCs[5]。因此,明确缺氧条件下 CCSMCs 内炎症反应对于探索 ED 潜在的治疗策略具有重要意义。
-
缺氧是一种常见的病理生理状态,可以引发细胞内复杂信号通路的激活。在炎症反应的早期阶段,TNF-α被激活并同时促进其他炎症介质的生成和释放,以及多个细胞信号通路的激活,如 NF-кB 信号途径,后者增加了 IL-6 基因的转录[11]。IL-1β是早期炎症过程中的典型细胞因子之一,它能够有效地促进 TNF-α的产生并刺激 IL-6 的生成。TNFα和 IL-1β的存在会对 IL-6 的水平产生影响,而 IL-6 主要参与急性炎症反应,并且还会对肝脏产生影响,从而促进 C 反应蛋白的产生[12-13]。IL-18 在慢性炎症的进展过程中扮演着重要角色[14]。最早对缺氧做出反应的转录因子是缺氧诱导因子(hypoxiainducible factor,HIF),其在调节炎症相关因子表达水平方面亦发挥作用,还扮演着重要的角色[15-16]。研究发现,HIF-1α通过激活一系列炎症触发物质,如 COX2 和 TLR4,间接促进了 IL-6 的表达[17]。而抑制 HIF-1α的表达能够显著降低血清中炎症因子 TNF-α和 IL-6 的含量[18]。提示在 CCSMCs 缺氧后导致的炎症反应中,HIF-1α可能起到了调节作用,然而其潜在机制尚未完全揭示。
-
图3 番茄红素干预后 CCSMCs 内 HIF-1α 和炎症因子的表达情况
-
本研究对大鼠原代 CCSMCs 进行分离和培养,使用 CoCl2 创造了一个低氧条件下的体外细胞模型。通过 Western blottig 分析发现,HIF-1α蛋白的表达量明显增加,这验证了本研究建立的体外 CCSMCs 低氧模型的有效性。HIF-1α既是缺氧诱导因子,又具有调节炎症因子的作用。本研究进一步探究了缺氧对 CCSMCs 中炎症因子表达的影响,经 RT-qPCR 分析发现,在缺氧状态下,关键炎症介质诸如 TNF-α、IL-6、IL-18 及 IL-1β的 mRNA 表达量显著升高。通过 Western blotting 方法进行的蛋白质表达量分析与 RT-qPCR 检测的 mRNA 变化趋势略有不同。与正常对照组相比,CoCl2 处理组 TNFα、IL-6 和 IL-18 的蛋白表达显著提高,IL-1β虽有上升趋势,但在统计学上差异并不显著。这可能是因为蛋白质的表达受翻译后调控的影响,导致表达变化落后于 mRNA 水平的改变。以上实验结果表明,缺氧可以导致 CCSMCs 内炎症因子的表达上调,并且可能与 HIF-1α有关。
-
番茄红素是存在于植物中的天然物质,属于类胡萝卜素家族 [19]。有报道称番茄红素能有效降低 HIF-1α的水平[20]。Gao 等[6]指出番茄红素能改善 ED 患者的勃起功能。本研究首先使用不同浓度的番茄红素干预缺氧 CCSMCs,使用 CCK8 法检测细胞活力发现,40 μmol/L 浓度的番茄红素可以有效提高细胞活力至正常水平的 80%。在经过番茄红素处理后的治疗组中,相比 CoCl2 组,HIF-1α、TNF-α和 IL-18 的蛋白表达水平明显降低,IL-6 和 IL-1β的蛋白含量也有所减少,但无统计学差异。相较于 CoCl2 组,经番茄红素干预后的细胞中,HIF-1α、 TNF-α和 IL-18 的蛋白表达水平明显下降,IL-6 和 IL-1β的蛋白含量虽有所减少,但并未达到具有统计意义的水平。同样,TNF-α、IL-1β和 IL-18 的 mRNA 水平也出现了明显的降低,但 IL-6 的 mRNA 水平无统计学意义。原因可能是调控 HIF-1α所需的番茄红素剂量不足,或 HIF-1α对炎症因子的调控可能牵涉到尚未阐明的信号转导机制,或番茄红素对 IL-6 和 IL-1β表达的直接或间接影响亦不应被排除。
-
本研究揭示了缺氧条件在体外对 CCSMCs 内炎症因子表达的影响,其潜在机制可能涉及 HIF1-α对这些炎症因子的调节。进一步观察发现,番茄红素在减缓 CCSMCs 中因缺氧引起的炎症因子表达层面表现出显著的效果。然而,本研究尚未详尽探讨 HIF-1α在炎症因子调节过程中的确切机制,后续工作应当基于动物实验或使用人源化模型进一步揭示这一调节机制。这有望对阐明缺氧诱发的炎症在 ED 发病中的作用提供更加深入的认识,并对番茄红素在临床上的应用前景提供了新的启示。
-
参考文献
-
[1] Lewis JM,Osbourne AL,O’leary MP.Erectile dysfunction [J].J Med Liban,2004,52(4):213-216.
-
[2] Costa P,Potempa AJ.Intraurethral alprostadil for erectile dysfunction:a review of the literature[J].Drugs,2012,72(17):2243-2254.
-
[3] Liu GD,Zhang YY,Zhang W,et al.Novel predictive risk factor for erectile dysfunction:Serum high-sensitivity C-reactive protein[J].Andrology,2022,10(6):1096-1106.
-
[4] Zhu BB,Niu YJ,Guo HQ,et al.Pyroptosis and inflammation-mediated endothelial dysfunction may act as key factors in the development of erectile dysfunction(Review)[J].Mol Med Rep,2023,28(3):165.
-
[5] Christ GJ.The control of corporal smooth muscle tone,the coordination of penile erection,and the etiology of erectile dysfunction:the devil is in the details [J].J Sex Educ Ther,1998,23(3):187-193.
-
[6] Gao JX,Li Y,Zhang HY,et al.Lycopene ameliorates erectile dysfunction in streptozotocin-induced diabetic rats [J].Pharmazie,2012,67(3):256-259.
-
[7] Tang CG,Li QH,Lin T.Lycopene attenuates Staphylococcus aureus-induced inflammation via inhibitingα-hemolysin expression[J].Microbes Infect,2021,23(9/10):104853.
-
[8] Chung H,Jung SH,Ryu JK,et al.Isolation and characterization of smooth muscle cells from rat corpus cavernosum tissue for the study of erectile dysfunction[J].Korean J Urol,2012,53(8):556-563.
-
[9] Pilatz A,Schultheiss D,Gabouev AI,et al.Isolation of primary endothelial and stromal cell cultures of the corpus cavernosum penis for basic research and tissue engineering[J].Eur Urol,2005,47(5):710-718;discussion 718-719.
-
[10] Kaya-Sezginer E,Gur S.The inflammation network in the pathogenesis of erectile dysfunction:attractive potential therapeutic targets[J].Curr Pharm Des,2020,26(32):3955-3972.
-
[11] Zelová H,Hošek J.TNF-α signalling and inflammation:interactions between old acquaintances[J].Inflamm Res,2013,62(7):641-651.
-
[12] Al-Roub A,Al Madhoun A,Akhter N,et al.IL-1β and TNFα cooperativity in regulating IL-6 expression in adipocytes depends on CREB binding and H3K14 acetylation [J].Cells,2021,10(11):3228.
-
[13] Ngwa DN,Pathak A,Agrawal A.IL-6 regulates induction of Creactive protein gene expression by activating STAT3 isoforms[J].Mol Immunol,2022,146:50-56.
-
[14] Berger M,Maqua H,Lysaja K,et al.Platelets from patients with chronic inflammation have a phenotype of chronic IL-1β release [J].Res Pract Thromb Haemost,2024,8(1):102261.
-
[15] Balamurugan K.HIF-1 at the crossroads of hypoxia,inflammation,and cancer[J].Int J Cancer,2016,138(5):1058-1066.
-
[16] Frede S,Berchner-Pfannschmidt U,Fandrey J.Regulation of hypoxia-inducible factors during inflammation [J].Methods Enzymol,2007,435:405-419.
-
[17] Akhtar S,Hartmann P,Karshovska E,et al.Endothelial hypoxiainducible factor-1α promotes atherosclerosis and monocyte recruitment by upregulating microRNA-19a [J].Hypertension,2015,66(6):1220-1226.
-
[18] Gao XH,Li YH,Wang HX,et al.Inhibition of HIF-1α decreases expression of pro-inflammatory IL-6 and TNF-α in diabetic retinopathy[J].Acta Ophthalmol,2017,95(8):e746-e750.
-
[19] Wei RR,Lin QY,Adu M,et al.The sources,properties,extraction,biosynthesis,pharmacology,and application of lycopene [J].Food Funct,2023,14(22):9974-9998.
-
[20] Zhao Y,Ma DX,Wang HG,et al.Lycopene prevents DEHP-induced liver lipid metabolism disorder by inhibiting the HIF-1αinduced PPARα/PPARγ/FXR/LXR system[J].J Agric Food Chem,2020,68(41):11468-11479.
-
摘要
目的:探索缺氧对SD大鼠海绵体平滑肌细胞(CCSMCs)内炎症反应的诱导作用及番茄红素调节效应。方法:分离SD大鼠原代CCSMCs并连续观察第4代海绵体平滑肌细胞内的形态稳定性;为了验证所培养的CCSMCs的纯度,进行了α-平滑肌肌动蛋白(α-SMA)和波形蛋白(desmin)的免疫荧光染色;不同浓度的CoCl2和番茄红素单独或联合干预海绵体平滑肌细胞24 h后,使用细胞计数试剂盒-8(CCK8)检测细胞活力;设立3个细胞处理组别:对照组、缺氧组(CoCl2 200 μmol/L)和番茄红素治疗组(40 μmol/L);培养24 h后,应用蛋白质印迹法(Western blotting)和反转录定量聚合酶链式反应(RT-qPCR)检测缺氧诱导因子1α(HIF-1α)、肿瘤坏死因子α(TNF-α)、白细胞介素(IL)-6、IL-18、IL-1β水平。结果:提取的SD大鼠海绵体平滑肌细胞在培养至第4代时依旧保持了形态上的均一性,经α-SMA和Desmin染色均显示出纯度较高的阳性反应。200 μmol/LCoCl2 处理后CCSMCs的活力下降到50%,且Western blotting和RT-qPCR检测细胞内HIF-1α、TNF-α、IL-6、IL-18的水平均呈上升趋势(P<0.05),IL-1β的mRNA表达亦显著升高(P<0.05),但蛋白表达量仅有升高趋势(P>0.05);40 μmol/ L番茄红素能将CCSMCs的活力得以提升至正常状态的80%,同时显著降低HIF-1α、TNF-α、IL-18的蛋白表达量和TNF-α、IL-18、IL-1β的mRNA表达量(P<0.05),IL-6的蛋白、mRNA及IL-1β的蛋白表达量仅有下降趋势(P>0.05)。结论:缺氧条件下,CCSMCs中炎症因子表达上调,番茄红素能有效抑制炎症因子表达。
Abstract
Objective To explore the hypoxia-induced inflammatory response in corpus cavernosum smooth muscle cells (CCSMCs) of SD rats and the regulatory effect of lycopene. Methods Primary CCSMCs were isolated from SD rats and observed for morphological stability up to the fourth passage. Immunofluorescence staining for α-smooth muscle actin (α-SMA) and desmin was performed to verify the purity of cultured CCSMCs. After 24 hours of exposure to different concentrations of CoCl2 and lycopene, either alone or in combination, cell viability was assessed using the Cell Counting Kit-8 (CCK8). The experiment included three treatment groups: control, hypoxia (200 μmol/LCoCl2), and lycopene treatment (40 μmol/L). Western Blotting and reverse transcription quantitative polymerase chain reaction (RT-qPCR) were used to detect the levels of hypoxia-inducible factor 1-alpha (HIF-1α), tumor necrosis factor-alpha (TNF-α), interleukin-6 (IL-6), interleukin-18 (IL-18), and interleukin-1 beta (IL-1β) after 24 hours of culture. Results The CCSMCs maintained morphological uniformity up to the fourth passage. High purity was confirmed through positive staining for α-SMA and desmin. Following 200 μmol/L CoCl2 treatment, CCSMCs viability decreased to 50%, with increases in intracellular levels of HIF-1α, TNF-α, IL-6, IL-18 (P<0.05), and a significant rise in IL-1β mRNA expression (P<0.05), though protein levels showed only an increasing trend (P>0.05). Lycopene at 40 μmol/L elevated CCSMC viability to 80% of normal levels and significantly reduced HIF-1α, TNF-α, IL-18 protein expression, and TNF-α, IL-18, IL-1β mRNA levels (P<0.05). IL-6 protein, IL-6 mRNA, and IL-1β protein levels showed a decreasing trend (P>0.05). Conclusion Under hypoxic conditions, the expression of inflammatory factors in CCSMCs is upregulated, and lycopene can effectively inhibit the expression of these inflammatory factors.
Keywords
Hypoxia ; corpus cavernosum smooth muscle cells ; inflammatory factors ; lycopene