-
直肠腔内超声(endorectal ultrasound,ERUS)可作为直肠癌的常用检查方法,优点是可清晰显示各个层面的直肠壁,缺点是可能无法对重叠的直肠癌得以清晰扫描[1]。剪切波弹性成像(shear wave elastrography,SWE)是通过编码对成像系统中获得的横波处理,从而表现出组织弹性图像的方法,可以依据组织弹性硬度评估肿瘤良恶性[2]。但SWE易受肿瘤大小、良恶性肿瘤图像重叠等因素影响,从而造成误诊。超声造影(contrast-enhanced ultrasound,CEUS)利用造影剂对血液背向散射进增强,可以清晰地显示微血管走形及病灶组织血供情况,从而鉴别良恶性肿瘤[3]。目前临床采用ERUS联合SWE及CEUS分析评估直肠癌的研究较少。本研究将多模态超声参数术前评估与直肠癌术后病理结果对比分析,现报道如下。
-
1 资料与方法
-
1.1 一般资料
-
选取2020年1月—2022年4月在我院治疗的直肠占位病变患者100例,其中男性68例,女性32例;年龄42~71岁,平均(56.8±9.1)岁;体质量指数19.12~24.40 kg/m2,平均(21.79±2.10)kg/m2。纳入标准:1)经术后病理学确诊;2)术前接受经直肠ERUS、SWE和CEUS检查;3)病灶远端距离肛门边缘≤10 cm;4)病灶为原发灶,且无远处转移;5)患者及家属知情同意。排除标准:1)图像质量差;2)已接受过新辅助治疗、放化疗等治疗;3)病灶导致腔内探头不能通过者;4)合并其他系统恶性肿瘤者。本研究获得医院伦理委员会批准(审批号:KYLL-2022-27)。
-
1.2 检查方法
-
1.2.1 ERUS检查
-
使用飞利浦EPIQ Elite超声诊断仪,C10-3v腔内探头,探头的频率为3~10 MHz。患者采取左侧卧位,屈髋屈膝,使双腿贴于腹部。用触诊法初步确定直肠肿瘤位置后,将探头伸入进行扫描探查,记录肿瘤最大径、血流峰值流速、阻力指数、内部回声、形态、边缘等情况。
-
淋巴结转移评估标准[4]:N0表示无淋巴结转移;N1、N2、N3表示有淋巴结转移。依据淋巴大小及形态评估是否出现转移,最大直径>5 mm、低回声、边界不清的淋巴结提示为淋巴结转移;未显示有淋巴结或最大直径<5 mm,提示为无淋巴结转移。
-
1.2.2 SWE检查
-
使用飞利浦EPIQ Elite超声诊断仪,C10-3v腔内探头,探头的频率为3~10 MHz。调节探头,使焦点、动态范围、深度等得以优化,清晰显示肿物,采用Q-box系统检查病灶组织硬度,记录病灶、周围脂肪、肠壁的杨氏模量值,取最大值(Emax)、平均值(Emean)和最小值(Emin)。
-
1.2.3 CEUS检查
-
使用超声诊断仪,双平面腔内探头,探头的频率为5~18 MHz,造影剂采用声诺维造影剂。患者采取左侧卧位,屈髋屈膝,使双腿贴于腹部。将探头缓缓地伸入直肠,进行多切面扫描,观察病变组织的大小及位置,对病变的内部回声、淋巴结数量及大小重点观察。切换成超声造影模式,对造影参数进行设置,灰阶增益88%,声压40~60 kPa,对患者静脉团注2.4 mL混悬液,随后注射5.0 mL生理盐水进行冲管,开启采集造影图像程序,存储2 min的实时影像。采用定量分析软件对图像进行分析,导入造影图像,获取感兴趣区灌注图像。
-
1.2.4 病理检查
-
用40 g/L多聚甲醛溶液固定标本,常规石蜡包埋,HE染色。随后由病理学专家对肿瘤浸润程度、有无转移癌灶及淋巴结数量评估。
-
1.3 统计学处理
-
统计分析采用SPSS 22.0软件,采取Bartlett方差齐性检验与Kolmogorov-Smirnov正态性检验,均确认服从正态分布计量资料,包括年龄、体质量指数、RT、TTP等指标,采用形式表示,两组间差异比较使用两独立样本t检验;计数资料包括性别等指标,采用n(%)表示,组间比较使用χ2检验;以ERUS、SWE、CEUS参数构建预测直肠恶性病灶的多因素Logistic回归方程,并采用受试者工作特征(ROC)曲线分析其预测价值。检验水准a=0.05。
-
2 结果
-
2.1 术后病理结果
-
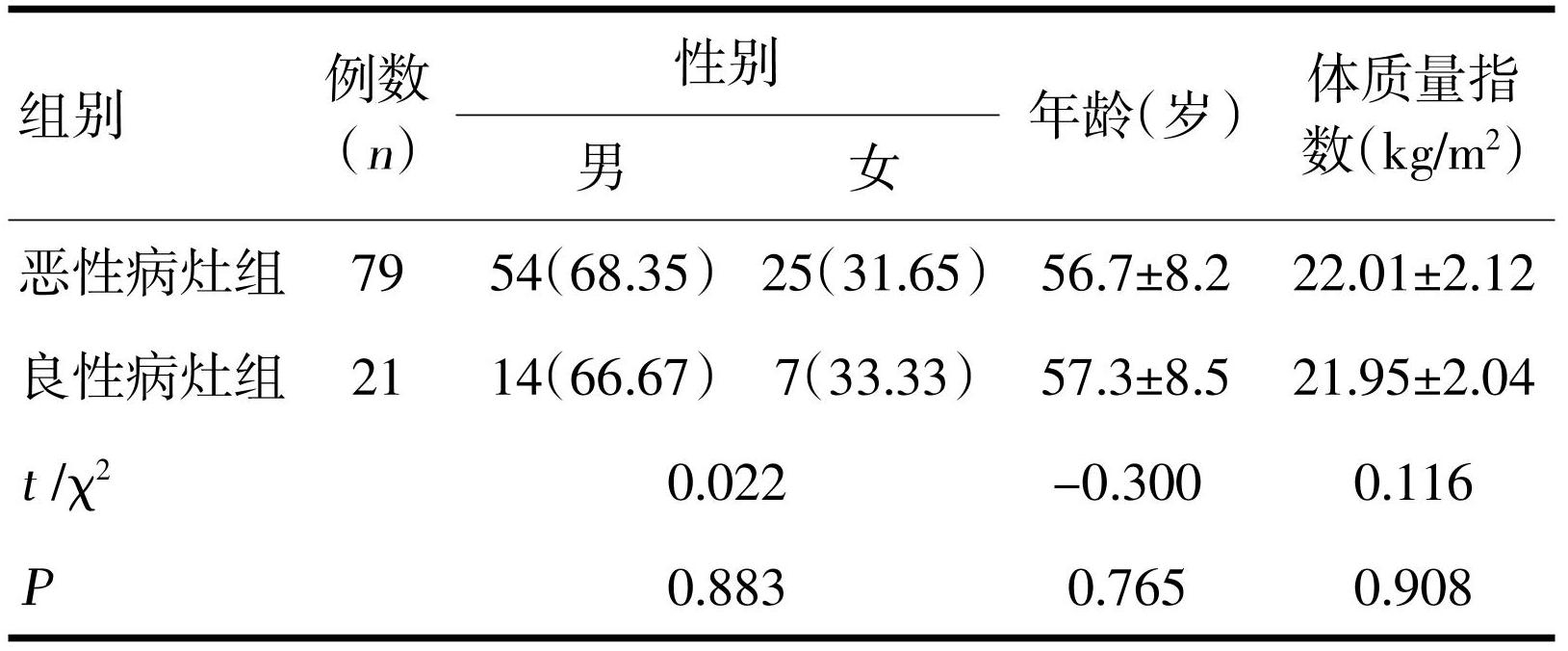
100例患者中直肠恶性病灶79例,均为腺癌;良性病灶21例,其中腺瘤16例,炎性病变5例。直肠恶性病灶与良性病灶患者的性别、年龄、体质量指数等一般资料方面比较,无统计学差异(P>0.05),见表1。
-
2.2 恶性与良性病灶ERUS参数比较
-
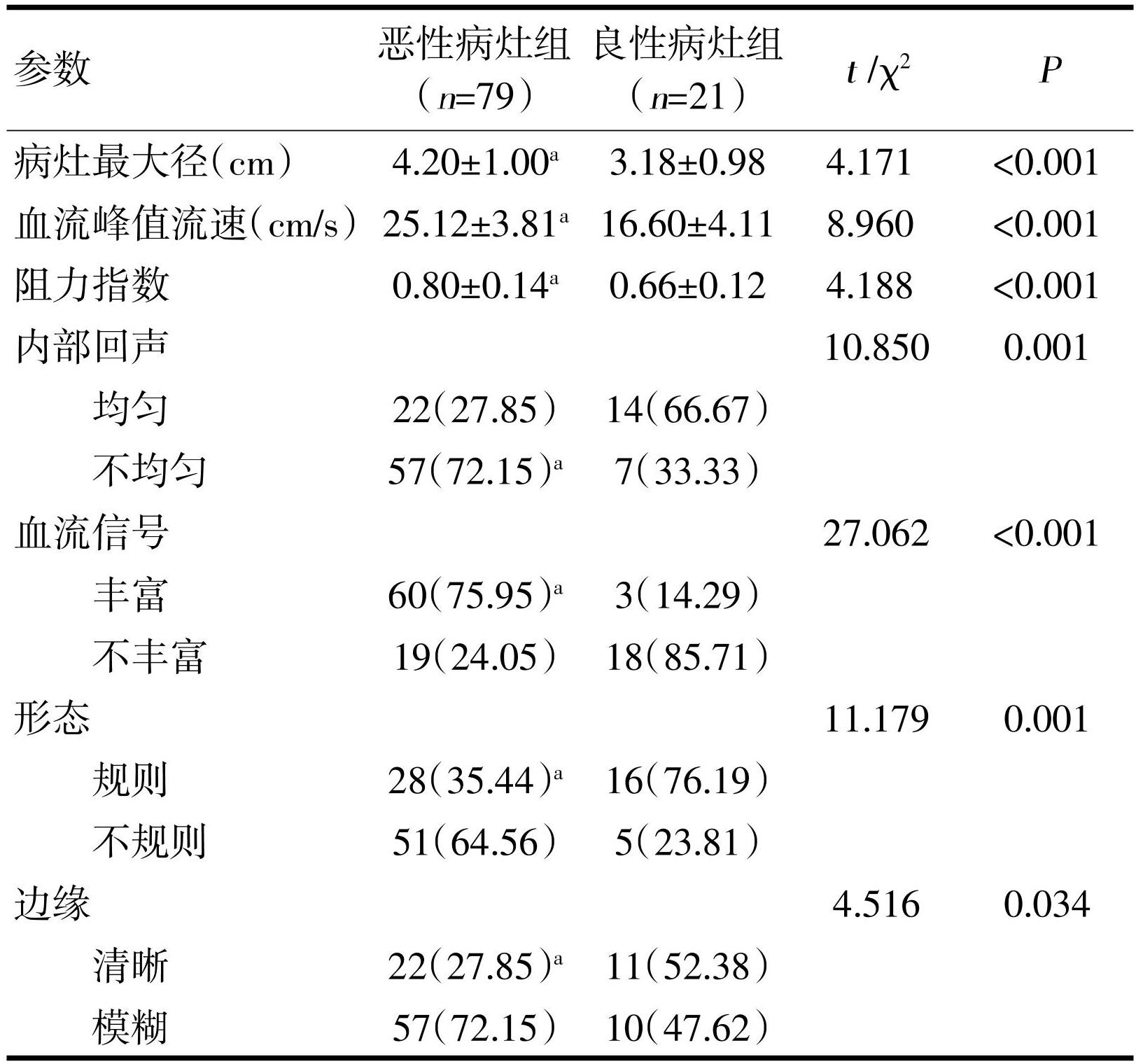
恶性病灶最大径、血流峰值流速和阻力指数,以及内部回声不均匀、血流信号丰富、形态不规则和边缘模糊比例明显高于良性病灶,差异有统计学意义(P<0.05),见表2。
-
注:a与良性病灶比较,P<0.05
-
2.3 恶性与良性病灶SWE参数比较
-
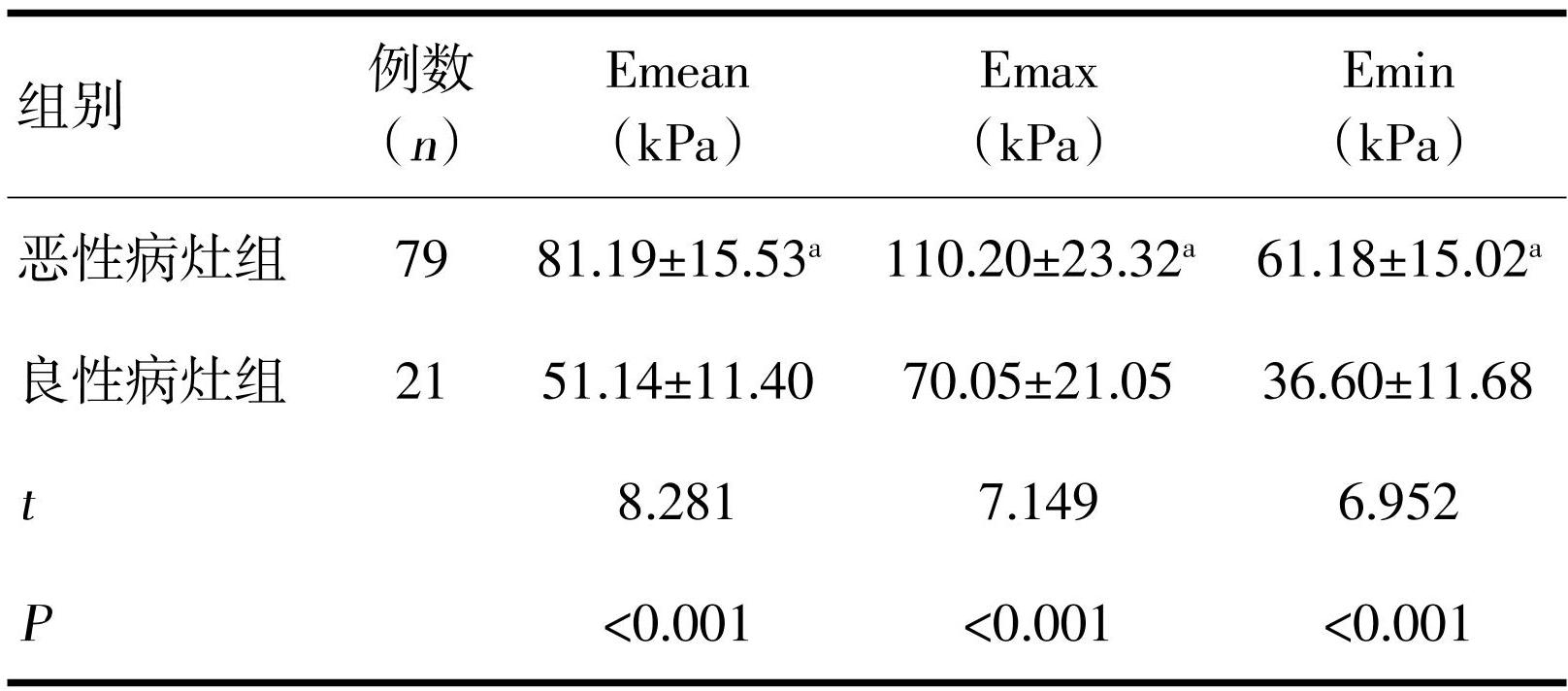
恶性病灶Emean、Emax和Emin明显高于良性病灶,差异有统计学意义(P<0.05),见表3。
-
注:a与良性病灶比较,P<0.05
-
2.4 恶性与良性病灶CEUS参数比较
-
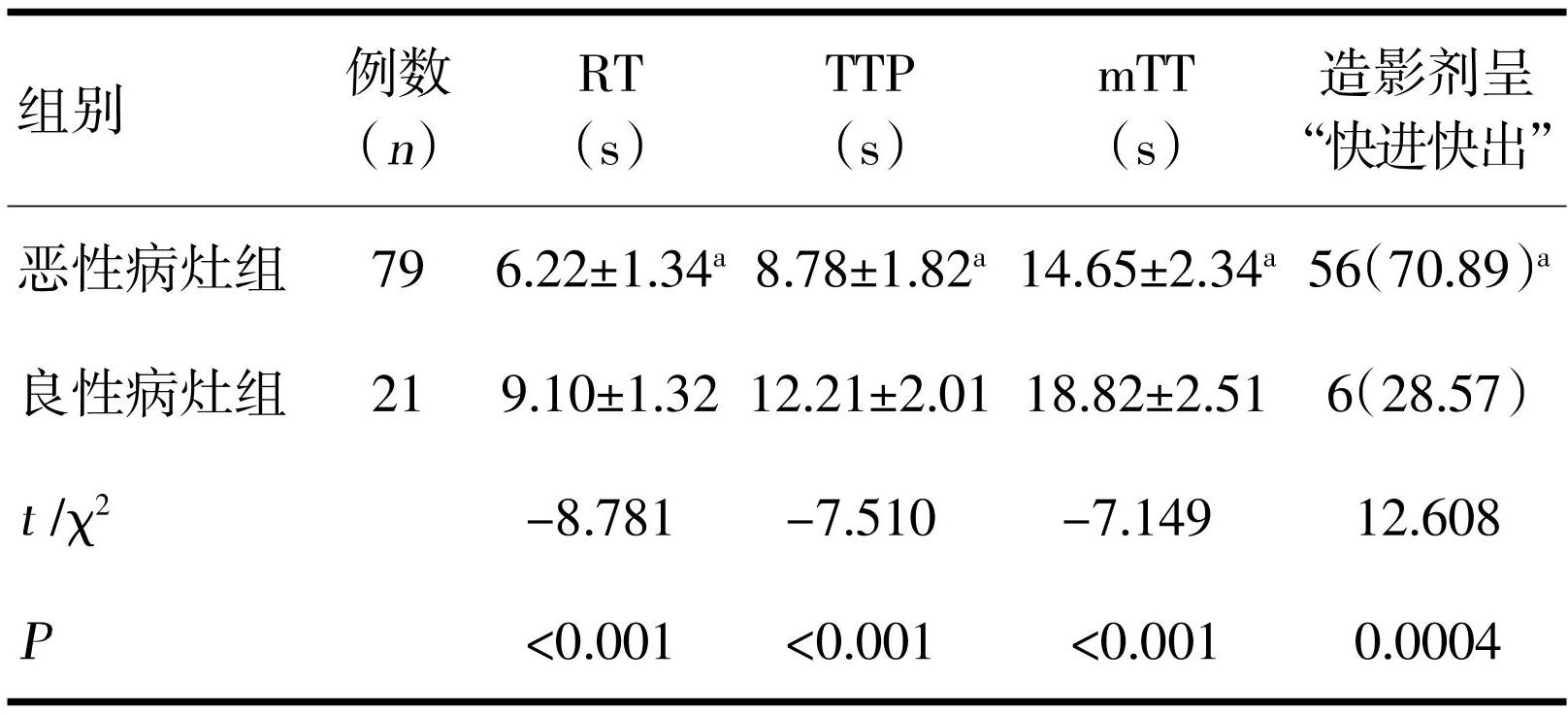
恶性病灶RT、TTP和mTT明显短于良性病灶(P<0.05),而造影剂呈“快进快出”比例明显高于良性病灶(P<0.05),见表4。
-
注:a与良性病灶比较,P<0.05
-
2.5 Logistic回归方程预测直肠恶性病灶的价值
-
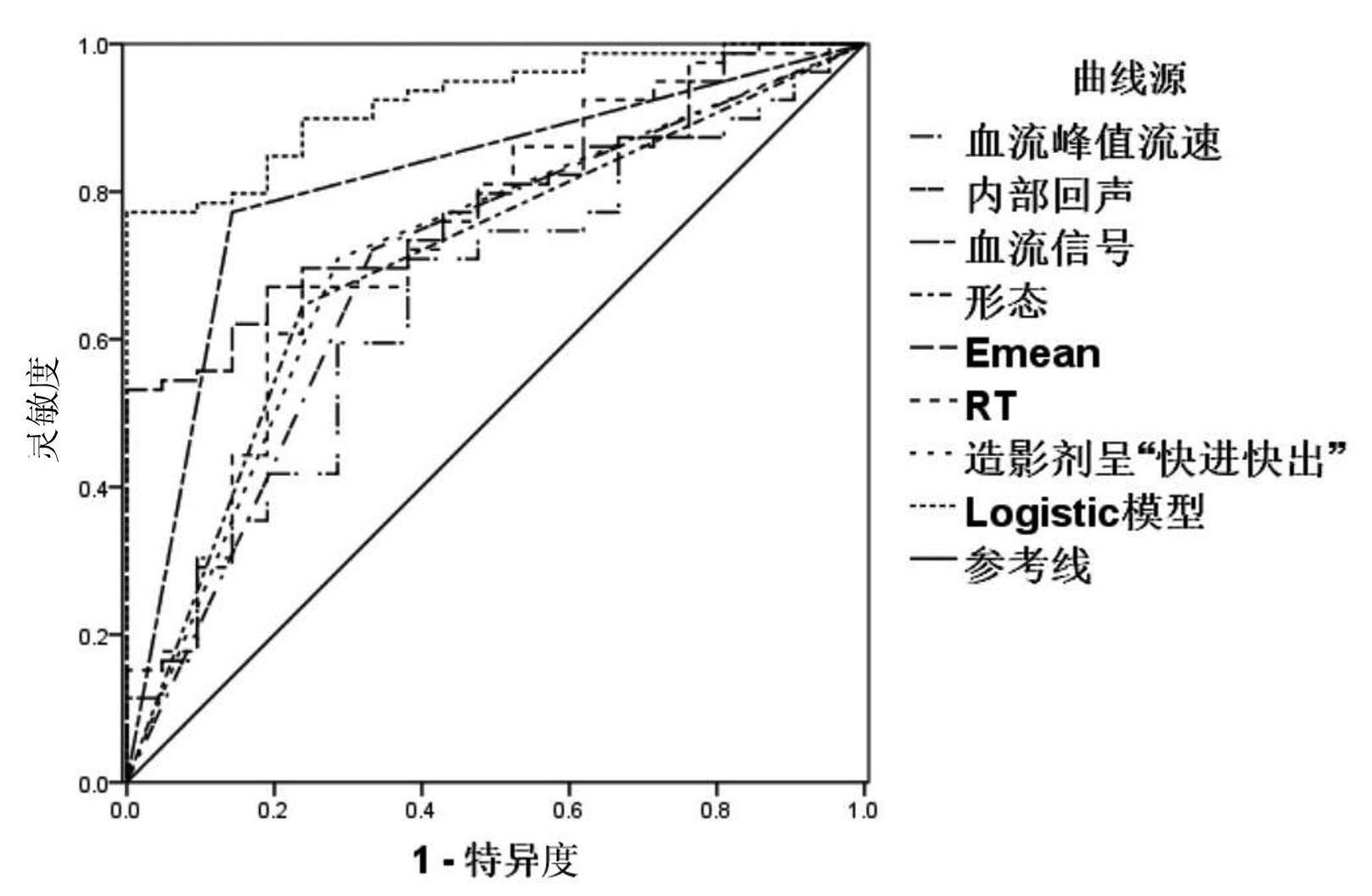
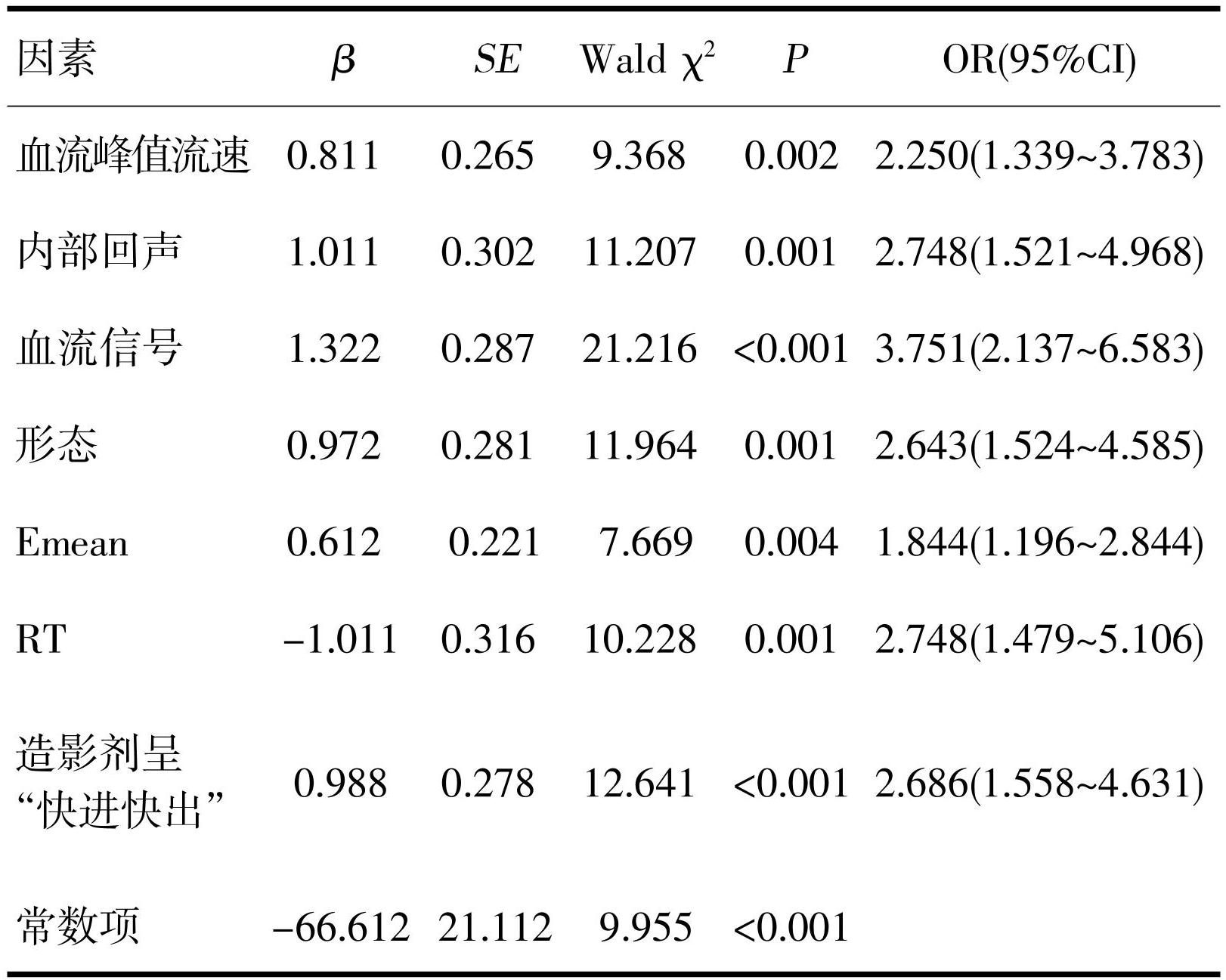
将EURS、SWE、CEUS参数构建Logistic回归方程,参数见表5。该方程预测直肠恶性病灶的ROC曲线下面积为0.892(95%CI:0.828~0.956),灵敏度和特异度分别为83.50%和76.20%,明显高于其他参数(P<0.05),见图1。
-
图1 Logistic回归方程及其他参数预测直肠恶性病灶的ROC曲线图
-
3 讨论
-
直肠肿瘤可分为良性和恶性肿瘤,恶性肿瘤早期无明显症状,不断恶化可致患者出现血便等现象,进而发生转移,侵及临近组织[5]。直肠癌检查的“金标准”是病理组织检查,但其对人体损伤较大,因此无创的影像检查就逐渐成为必要,同时可以较早地对肿瘤进行检查[6]。以超声为媒介的影像检查能及时检出病灶组织,进而可使患者避免活检损伤。
-
本研究结果显示,恶性病灶最大径、血流分组流速和阻力指数,以及内部回声不均匀、血流信号丰富、形态不规则和边缘模糊比例明显高于良性病灶,说明直肠良恶性肿瘤的ERUS检查结果存在明显差异,上述指标对于直肠良恶性肿瘤的鉴别有一定的价值。ERUS是直肠癌患者首选的影像检查手段,也是评估病灶浸润的方法[7]。ERUS能反映肿瘤内血管生长和血流情况,这与肿瘤浸润转移相关联。直肠恶性肿瘤好发于腺上皮,其形态不规则,肿瘤会诱导病灶组织形成肿瘤血管,使细胞失去极向,进而造成血管瘤出血,增加坏死风险,ERUS下可观察到点线状血管及低回声肿块影像,因此会呈现出丰富的血流信号[8]。随病程进展,恶性癌细胞出现增殖,肿瘤组织间排列紊乱,肿瘤内形成动静脉痿,因此内部回声不均。恶性肿瘤易发生淋巴转移,侵及周围正常组织,进而使病灶组织增大,因此常呈现出形态不规则且边缘模糊的影像[9]。
-
本研究结果显示,恶性病灶Emean、Emax和Emin明显高于良性病灶,说明直肠恶性肿瘤的组织硬度较高。SWE在组织内产生剪切波,并经过弹性成像系统追踪此类波,最后使用编码技术呈现组织弹性图,同时经过检查杨氏模量结果来反应组织软硬度[10],因此可用此现象对肿瘤良恶性进行判断。病灶的特性可由病灶软硬度反应,一般良性肿瘤组织较软,而恶性肿瘤组织较硬,因此可经过杨氏模量值诊断病灶病理程度[11]。
-
本研究结果显示,恶性病灶RT、TTP和mTT明显短于良性病灶,而造影剂呈“快进快出”比例明显高于良性病灶,说明直肠良恶性肿瘤的血流灌注情况存在明显差异。本研究中,恶性肿瘤组超声造影,RT、TTP及mTT均比良性病灶组低。原因可能受到恶性肿瘤内新生血管的影响,肿瘤内新生血管分布杂乱,减少了血管壁肌层,造成动静脉瘘,使肿瘤灌注量增加,能加快造影剂代谢[12]。肿瘤动脉期影像表现为均匀或不均匀显著增强,病灶迅速增强随后即刻消退,临床称此现象为“快进快出”[13]。肿瘤门脉期是低增强期,实质期也呈低增强现象,且肿瘤呈低回声。直肠肿瘤恶化发生转移时,易沿着门静脉血流转移,进而易导致肝腹水、黄疸等伴随病症。在直肠发生癌变时,其血供主要来自肠系膜下动脉,因此在注射造影剂后,在较短时间内直肠恶性肿瘤的造影剂浓度显著高于良性肿瘤,影像上表现为恶性肿瘤信号显著增强,明显高于良性肿瘤;当肿瘤组织从直肠静脉及静脉肛管系统获取较多造影剂时,肿瘤组织内的造影剂已显著减少,在影像上表现为信号降低,显著低于正常直肠组织,呈现出“快进快出”状态[14-15]。
-
为探究多模态超声对于直肠良恶性肿瘤的鉴别诊断价值,本研究进一步将EURS、SWE、CEUS参数构建Logistic回归方程并绘制ROC曲线。结果显示,该方程预测直肠恶性病灶的ROC曲线下面积为0.892,灵敏度和特异度分别为83.50%和76.20%,明显高于单一参数,说明EURS、SWE、CEUS对于直肠肿瘤具有较好的诊断价值,可用于直肠肿瘤良恶性的鉴别。
-
综上所述,构建多模态超声参数在鉴别直肠恶性病灶方面有较好的应用价值,值得进一步研究。
-
参考文献
-
[1] 翟志伟,张坤宁,王琛,等.中低位局部进展期直肠癌新辅助治疗与全程新辅助治疗的近期疗效和安全性比较[J].中华胃肠外科杂志,2020,23(3):274-280.
-
[2] 门杰,曾宁,关颖瑜,等.360度直肠腔内超声与多层螺旋CT对直肠癌TN分期的对比研究[J].中国CT和MRI杂志,2020,18(5):56-58.
-
[3] 陈晓琼,王月爱,李波.经直肠腔内超声与剪切波弹性成像在直肠癌诊断中的对比研究[J].临床超声医学杂志,2022,24(3):235-238.
-
[4] 刘波,王珍芳,张雪梅,等.经直肠超声联合超声造影对直肠间质瘤与直肠癌的鉴别诊断价值[J].现代肿瘤医学,2021,29(22):4010-4013.
-
[5] 陈晓丽,李杭,袁艺,等.扩散加权成像在评估直肠癌术前淋巴结转移和淋巴血管侵犯中的应用价值[J].川北医学院学报,2021,36(9):1124-1128.
-
[6] 卫洪波,雷普润.低位直肠癌根治术中Denonvilliers筋膜切除的争议[J].腹部外科,2020,33(1):4-8.
-
[7] Du L,Ha C.Epidemiology and pathogenesis of ulcerative colitis[J].Gastroenterol Clin North Am,2020,49(4):643-654.
-
[8] 任建伟,周祖邦,马雯娟.超声引导下热消融联合程序性死亡蛋白-1抑制剂治疗结直肠癌肝转移的研究进展[J].中国当代医药,2022,29(17):22-27.
-
[9] 宋玉娟.直肠腔内超声与MRI三维重建在直肠癌术前分期及环周切缘评估中的应用研究[J].中国CT和MRI杂志,2021,19(9):141-143.
-
[10] 张闻平,吴静,任彦军,等.直肠腔内超声与磁共振诊断直肠肿瘤的比较研究[J].首都医科大学学报,2020,41(4):641-646.
-
[11] 蔡彬,黄伟,利锡贵.直肠腔内超声与磁共振成像对直肠癌术前局部分期的准确性比较[J].广西医学,2020,42(2):125-128,133.
-
[12] 徐明达,张光晨,吴长君.剪切波弹性成像在直肠肿瘤的诊断及T分期中的应用的初步研究[J].哈尔滨医科大学学报,2020,54(2):192-196.
-
[13] 张珊珊,李诺,刘露,等.经直肠超声结合剪切波弹性成像在直肠癌诊断及TNM分期中的应用[J].中国现代医学杂志,2021,31(14):20-24.
-
[14] 林福臻,唐志良,梁敏玲.腹腔镜结直肠癌根治术后发生肺部感染的病原学及影响因素Logistic回归分析[J].数理医药学杂志,2022,35(4):536-539.
-
[15] 李媛,胡紫玥,王璐,等.经直肠超声引导下直肠肿瘤穿刺活检的应用价值[J].肿瘤预防与治疗,2022,35(3):262-266.
-
摘要
目的:探讨直肠肿瘤的多模态超声参数术前评估与术后病理结果的差异。方法:选取2020年1月—2022年4月在我院治疗的直肠占位病变患者100例,术前接受经直肠超声(ERUS)、剪切波弹性成像(SWE)和超声造影(CEUS)检查,分析直肠恶性与良性病灶的ERUS、SWE和CEUS参数差异,同时用ERUS、SWE和CEUS参数构建Logistic回归方程预测直肠恶性病灶的价值。结果:恶性病灶最大径、血流峰值流速和阻力指数高于良性病灶[(4.20±1.00)cm、(25.12±3.81)cm/s和(0.80±0.14)vs(3.18±0.98)cm、(16.60±4.11)和(0.66±0.12)cm/s],差异有统计学意义(P<0.05);恶性病灶内部回声不均匀、血流信号丰富、形态不规则和边缘模糊高于良性病灶[72.15%、75.95%、64.56%和72.15% vs 33.33%、14.29%、23.81%和47.62%],差异有统计学意义(P<0.05)。恶性病灶平均杨氏模量(Emean)、最大杨氏模量(Emax)和最小杨氏模量(Emin)高于良性病灶[(81.19±15.53)kPa、(110.20±23.32)kPa和(61.18±15.02)kPa vs (51.14±11.40)kPa、(70.05±21.05)kPa和(36.60±11.68)kPa],差异有统计学意义(P<0.05)。恶性病灶上升时间(RT)、达峰时间(TTP)和平均渡越时间(mTT)短于良性病灶[(6.22±1.34)s、(8.78±1.82)s和(14.65±2.34)s vs (9.10±1.32)s、(12.21±2.01)s和(18.82±2.51)s],差异有统计学意义(P<0.05),造影剂呈“快进快出”比例高于良性病灶[70.89% vs 28.57%],差异有统计学意义(P<0.05)。EURS、SWE、CEUS参数构建Logistic回归方程,该方程预测直肠恶性病灶的ROC曲线下面积为0.892(95%CI:0.828~0.956),灵敏度和特异度分别为83.50%和76.20%。结论:构建多模态超声参数在鉴别直肠恶性病灶方面有较好的应用价值,值得进一步研究。
Abstract
Objective To explore the differences between preoperative evaluation of multimodal ultrasound parameters and postoperative pathological outcomes of rectal tumors. Methods 100 patients with rectal space occupying lesions who were treated in our hospital from January 2020 to April 2022 were selected, and received transrectal ultrasound (ERUS), shear wave elastography (SWE), and contrast-enhanced ultrasound (CEUS). The difference of ERUS, SWE, and CEUS parameters between malignant and benign rectal lesions were analyzed. At the same time, the value of ERUS, SWE, and CEUS parameters to construct a Logistic regression equation to predict rectal malignant lesions were analyzed. Results The maximum diameter, peak blood flow velocity, and resistance index of malignant lesions were higher than those of benign lesions (4.20±1.00)cm, (25.12±3.81)cm/s and (0.80±0.14) vs (3.18±0.98)cm, (16.60±4.11), and (0.66±0.12) cm/s, respectively), and the difference was statistically significant (P<0.05). Malignant lesions have uneven internal echoes, rich blood flow signals, irregular morphology, and blurred edges, which are higher than benign lesions [proportions of 72.15%, 75.95%, 64.56% and 72.15% vs 33.33%, 14.29%, 23.81%, and 47.62%, respectively], and the differences were statistically significant and significantly higher than benign lesions (P<0.05). The average Young's modulus (Emean), maximum Young's modulus (Emax), and minimum Young's modulus (Emin) of malignant lesions were higher than those of benign lesions [(81.19±15.53)kPa, (110.20±23.32)kPa, and (61.18±15.02)kPa vs (51.14±11.40)kPa, (70.05±21.05)kPa, and (36.60±11.68)kPa, respectively)], with statistically significant differences compared to benign lesions (P<0.05). The rise time (RT), peak time (TTP), and mean transition time (mTT) of malignant lesions were shorter than those of benign lesions [(6.22±1.34)s, (8.78±1.82)s, and (14.65±2.34)s vs (9.10±1.32)s, (12.21±2.01)s, and (18.82±2.51)s, respectively)], and the differences were statistically significant and significantly shorter than benign lesions (P<0.05). The contrast agent showed a "fast in and fast out" pattern compared to benign lesions [(70.89% vs 28.57%)], The difference was statistically significant higher than that of benign lesions (P<0.05). The parameters of EURS, SWE and CEUS were used to construct a Logistic regression equation, which predicted the area under the ROC curve of rectal malignant lesions to be 0.892 (95% CI: 0.828~0.956), and the sensitivity and specificity were 83.50% and 76.20% respectively. Conclusion The construction of multimodal ultrasound parameters has good application value in the differential prediction of rectal malignant lesions, and it is worthy of further study.