-
胰腺癌是消化系统常见的恶性肿瘤,因早期症状不明显以及发生转移较早等特点,80%的患者在确诊时已错过了接受根治性手术的时机,加之胰腺癌对放化疗不敏感,其5年生存率低于10%,患者确诊后的平均生存期短,使其发病率与死亡率相近[1]。在我国,胰腺癌的发病率和死亡率呈上升态势[2]。代谢重编程是胰腺癌的主要特征之一。早在上世纪二十年代,德国生化学家瓦博格发现肿瘤细胞与正常细胞能量代谢的方式不同[3]。正常细胞靠氧化磷酸化获取能量,而肿瘤细胞即使在氧气充足的情况也利用糖酵解获取能量,肿瘤细胞的这种特性被称为瓦博格效应(Warburg effect)。瓦博格效应不仅能为肿瘤细胞提供能量,糖酵解途径中的三碳化合物还为肿瘤细胞内大分子的生物合成提供了物质基础,促进肿瘤的生长。
-
表没食子儿茶素没食子酸酯(epigallocatechin gallate,EGCG)是绿茶的主要成分,具有抗病毒、抗氧化、抗衰老、抗肿瘤等功效。研究表明,EGCG可以抑制肿瘤进展的多种生物学过程,包括抑制细胞增殖、侵袭、转移及血管生成,其还诱导细胞的凋亡和细胞周期阻滞[4]。胰腺癌细胞高表达胰岛素受体和胰岛素样生长因子I受体,当两受体被激活后,可通过下游磷脂酰肌醇3激酶(PI3K)-Akt和细胞外调节蛋白激酶(extracellular regulated protein kinases,ERK)两条信号通路进行细胞信号转导。PI3K-Akt信号通路参与细胞增殖、分化、凋亡的调控,其异常激活通常与恶性肿瘤的形成密切相关,也与肿瘤细胞的侵袭和转移相关。研究表明EGCG可抑制胰岛素受体和胰岛素样生长因子I受体的激活[5],作为谷氨酸脱氢酶的抑制剂,其可通过抑制谷氨酰胺代谢通路从而抑制癌细胞的生长[6],EGCG能否通过抑制PI3K-Akt通路影响胰腺癌细胞的生长和瓦博格效应目前尚不清楚。本研究以人胰腺癌PANC-1细胞为研究对象,旨在观察EGCG对胰腺癌细胞增殖和糖酵解的影响。
-
1 材料与方法
-
1.1 材料
-
人胰腺癌细胞系PANC-1(#CC2401)购自中国科学院上海细胞库。DMEM培养基、胎牛血清(FBS)和胰蛋白酶购自美国Gibco公司,无葡萄糖无酚红DMEM(#D6540)和青霉素链霉素购自北京索莱宝科技有限公司,EGCG(#E4143)购自美国Sigma公司。CCK8增殖毒性检测试剂盒(#C0037)购自北京碧云天公司。葡萄糖乳酸检测试剂盒购自南京建成生物技术有限公司,磷酸化PI3K和Akt抗体购自美国CST公司,己糖激酶-2(HK-2)、磷酸果糖激酶(PFK)、乳酸脱氢酶(LDH)和β-actin抗体购自美国Sanata Cruz公司,偶联辣根过氧化物酶(HRP)的山羊抗兔抗体和山羊抗小鼠抗体购自上海良森生物科技有限公司,小鼠抗山羊抗体购自北京中杉金桥生物技术有限公司。增强化学发光底物检测试剂盒购自美国Perkin Elmer公司。
-
1.2 方法
-
1.2.1 细胞培养
-
将人胰腺癌PANC-1细胞用含10% FBS、100 U/mL青霉素和100 mg/L链霉素的DMEM高糖培养基培养于37℃,5%CO2的培养箱中。
-
1.2.2 CCK8法检测EGCG对PANC-1细胞增殖的影响
-
用0.25%胰酶将PANC-1细胞消化成单细胞悬液,以每孔5×103个细胞接种于96孔板,置于37℃,5% CO2的培养箱中培养24 h。用不含血清的DMEM稀释EGCG,使其终浓度分别5、25、50、100、200 μmol/L,96孔板中每孔加入100 μL不同浓度的EGCG溶液,每个浓度5个复孔,阴性对照组加入不含血清的DMEM,于37℃、5%CO2培养箱中分别孵育24、48、72 h。到达孵育时间后,于96孔板中每孔加入10 μL CCK8溶液,继续培养2 h后,于酶标仪中在450 nm处测定各孔的光密度(OD)值。按以下公式计算细胞增殖抑制率(%)=(1-实验孔OD值/对照孔OD值)×100%。
-
1.2.3 葡萄糖乳酸试剂盒检测EGCG对PANC-1细胞糖酵解的影响
-
将PANC-1细胞经胰腺消化制成单细胞悬液后,均匀接种于6孔板,待细胞融合密度达到90%以上,将无葡萄糖无酚红DMEM配置成含11.1 mmol/L葡萄糖的溶液,再用此溶液配制不同浓度的EGCG,将终浓度分别为5、13、25、50、100 μmol/L的EGCG孵育PANC-1细胞6 h,对照组为含11.1 mmol/L葡萄糖的无酚红DMEM溶液,收集细胞上清液,根据葡萄糖乳酸检测试剂盒说明书的使用说明,检测上清液中葡萄糖乳酸的量。因为细胞上清液中不含乳酸,所以检测到的乳酸含量即为细胞糖酵解代谢产生的乳酸量,因细胞上清液中初始葡萄糖浓度为11.1 mmol/L,而本研究检测到的葡萄糖是细胞消耗葡萄糖后的剩余量,故细胞消耗的葡萄糖需用原始葡萄糖减去检测到的葡萄糖量,即为细胞消耗的葡萄糖。为抵消细胞群落大小不一可能给实验结果带来的影响,收集同组细胞,检测细胞裂解后的蛋白浓度,用细胞蛋白总量去校正葡萄糖消耗和乳酸生成。
-
1.2.4 Western blot法检测EGCG对糖酵解酶和磷酸化PI3K/Akt表达的影响
-
将PANC-1单细胞悬液接种于6孔板,细胞密度达90%以上,用不含血清的DMEM培养基配制终浓度分别为5、13、25、50、100 μmol/L的EGCG,于37℃,5% CO2的培养箱中孵育细胞6 h,裂解细胞,收集蛋白。取20 μg蛋白进行SDS-PAGE电泳,用Western blot法测糖酵解酶和磷酸化PI3K/Akt的表达。一抗4℃孵育过夜,二抗室温孵育2 h,以β-actin作为内参,增强化学发光底物试剂盒检测曝光,结果应用NIH Image J 软件进行分析。
-
1.3 统计学方法
-
数据用SPSS 22.0行统计学分析,符合正态分布的计量数据用均数±标准差()表示,多组间均数比较采用单因素方差分析,组间多重比较采用LSD-t检验。P<0.05为差异有统计学意义。
-
2 结果
-
2.1 EGCG对PANC-1细胞增殖的抑制作用
-
CCK-8结果显示,不同浓度的EGCG均能有效抑制PANC-1细胞的增殖,且抑制作用随着EGCG浓度的升高和作用时间的延长而增强,呈现出剂量依赖性和时间依赖性(P<0.05),见表1。
-
注:同一时点组间,a与对照组比,P<0.05;b与5 μmol/L组比较,P<0.05;c与25 μmol/L组比较,P<0.05;d与50 μmol/L组比较,P<0.05。同一浓度组内不同时点,e与24 h组比较,P<0.05;f与48 h组比较,P<0.05。
-
2.2 EGCG对PANC-1细胞糖酵解的影响
-
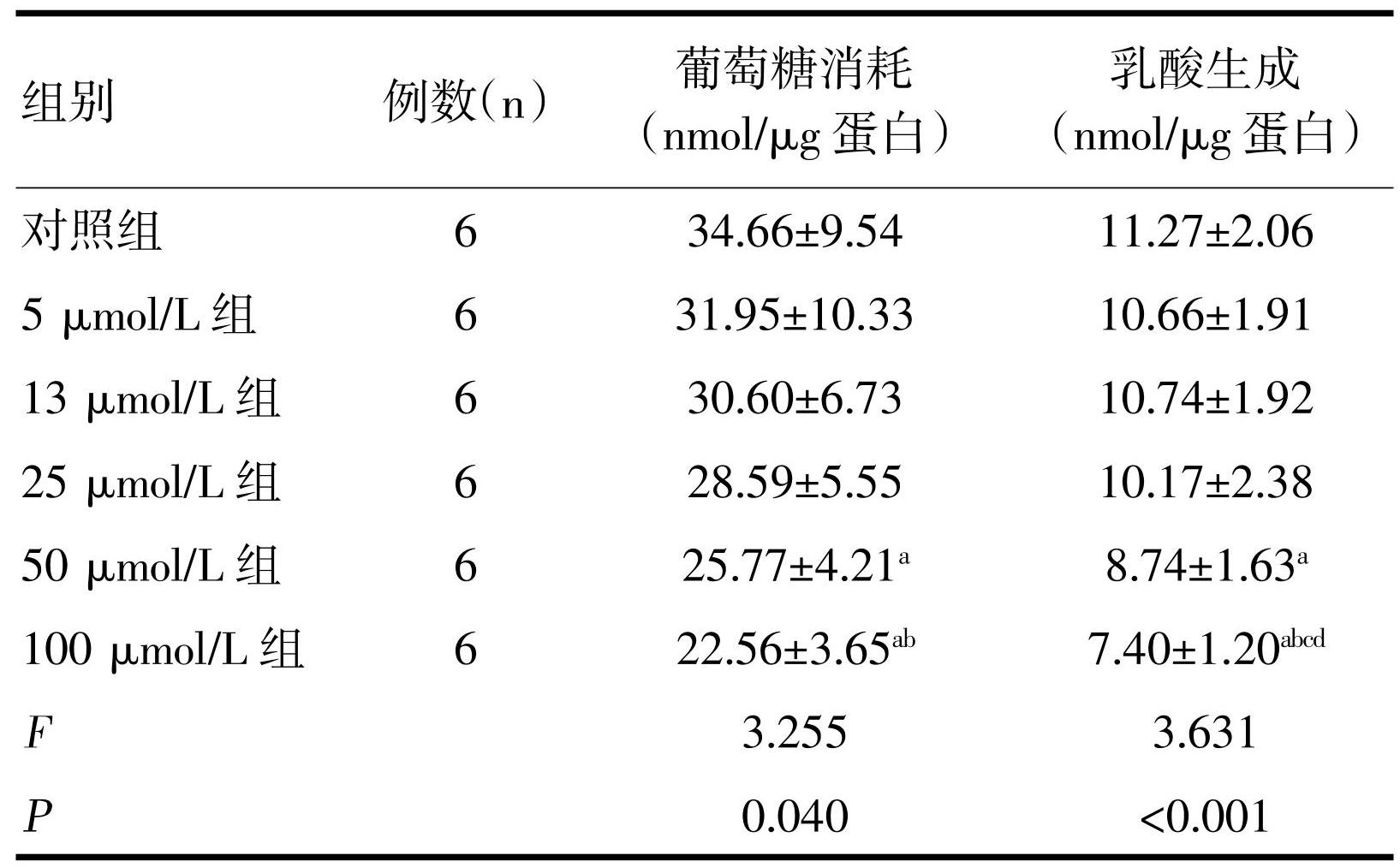
胰腺癌PANC-1细胞在6 h培养条件下的葡萄糖消耗量为(34.66±9.54)nmol/μg蛋白,EGCG作用6 h后在低浓度条件下可减少细胞葡萄糖的消耗,但无统计学差异。随着EGCG浓度升高,达到50 μmol/L时,EGCG抑制PANC-1细胞葡萄糖消耗,且具有统计学差异(P<0.05),EGCG对乳酸生成的影响亦是在低浓度时无统计学差异,达到50 μmol/L时,EGCG对乳酸生成的抑制具有统计学差异(P<0.05),见表2。
-
注:a与对照组比,P<0.05;b与5 μmol/L组比较,P<0.05;c与13μmol/L组比较,P<0.05;d与25 μmol/L组比较,P<0.05。
-
2.3 EGCG对PANC-1细胞糖酵解酶和磷酸化PI3K/Akt表达的影响
-
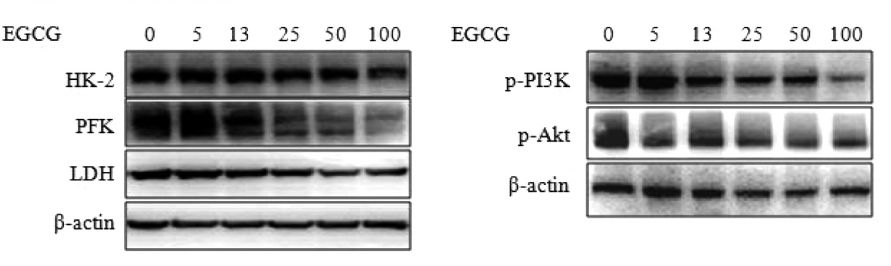
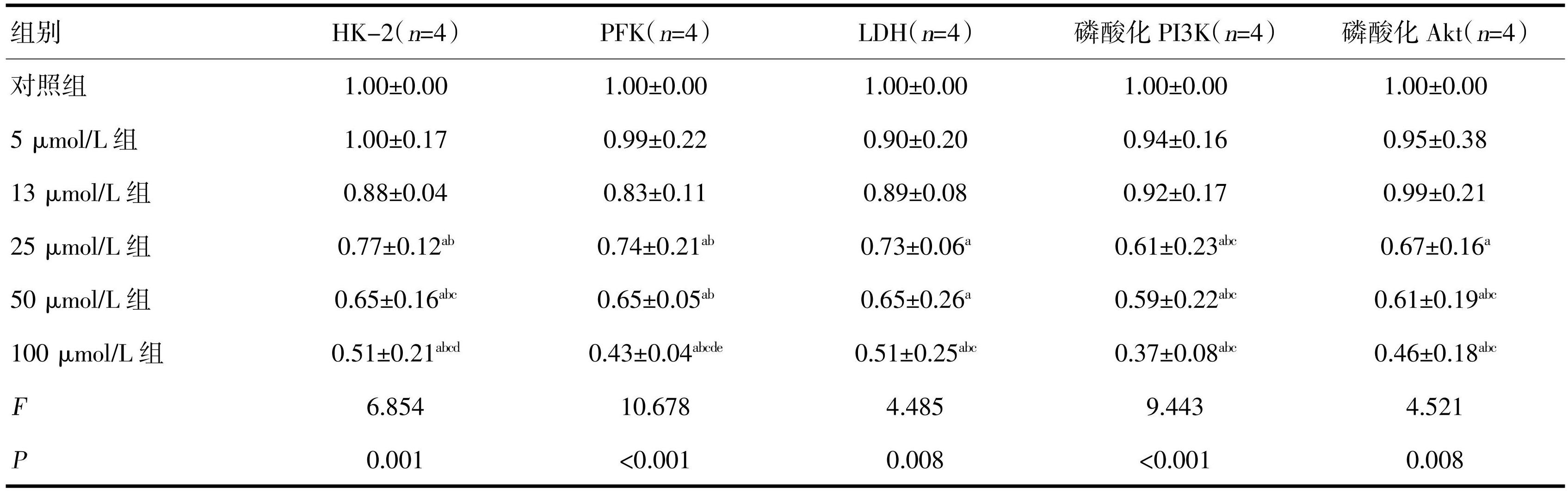
EGCG抑制了糖酵解酶HK-2、PFK和LDH的表达,浓度达到25 μmol/L时具有统计学意义,且随着EGCG浓度升高,抑制作用越明显。EGCG作为胰岛素受体和胰岛素样生长因子I受体的抑制剂,可抑制受体表达及受体后信号通路的激活,本研究结果显示EGCG抑制了磷酸化PI3K和Akt的表达,且其抑制作用具有剂量依懒性,即EGCG浓度越高,抑制作用越明显,见图1和表3。
-
图1 EGCG对糖酵解酶和磷酸化PI3K/Akt表达的影响
-
注: a与对照组比较,P<0.05;b与5 μmol/L组比较,P<0.05;c与13 μmol/L组比较,P<0.05;d与25 μmol/L组比较,P<0.05,e与50 μmol/L组比较,P<0.05
-
3 讨论
-
EGCG是绿茶中含量最多的茶多酚,也是绿茶儿茶素类的主成分。EGCG是一类既亲水又亲脂的两性分子,可经口服、灌胃、静脉注射等不同途径进入血液循环,其吸收程度会因给药途径不同而有所差异。在大鼠体内研究中,EGCG静脉注射的相对生物利用度高于灌胃给药,而在小鼠体内多数为灌胃给药,肠黏膜是EGCG浓度最高的部位,且EGCG的生物利用度明显高于大鼠。EGCG在体内经历了广泛的生物转化,主要包括甲基化、硫酸化和葡萄糖醛酸化反应,其排泄方式因给药途径不同及作用对象的不同而有所差异。小鼠灌胃EGCG后主要通过粪便排泄,而大鼠静脉注射EGCG后主要通过胆汁排泄。EGCG具有广泛的抗炎、抗氧化、抗纤维化、抗重塑和组织保护特性,有助于治疗各种疾病,特别是癌症、神经、心血管、呼吸和代谢疾病[7]。EGCG长期以来被认为可以抑制多种类型的肿瘤[8-10],EGCG可直接作用于肿瘤细胞,但因其在体内的吸收、分布、代谢、排泄会影响生物利用度及进一步的功能发挥,因此目前主要通过化学修饰法和酶法修饰提高EGCG的脂溶性或利用脂质体和纳米制剂提高稳定性,进而改善其生物利用度。最近的研究表明EGCG对皮肤癌、肺癌、乳腺癌、结肠癌、肝癌、胃癌和前列腺癌有潜在的化疗疗效[11-12]。由于EGCG与细胞内信号通路和核转录因子的多种相互作用,其可抑制肿瘤进展的多种生物学过程,包括细胞增殖和肿瘤生长、侵袭和转移以及血管生成,并诱导转化细胞的凋亡和细胞周期阻滞[13-14]。EGCG还可抑制血管内皮生长因子受体、血小板衍生生长因子受体、胰岛素受体和胰岛素样生长因子I受体的激活,根据不同的细胞环境,作用于不同的靶点。本研究探索了EGCG单独作用于胰腺癌PANC-1细胞,观察其对细胞增殖的抑制作用,结果显示EGCG对PANC-1细胞增殖的抑制作用具有剂量和时间依赖性。
-
肿瘤细胞与正常细胞不同,它们具有迅速应对缺氧和低营养条件的适应性反应,由此引起的肿瘤细胞能量代谢变化的现象,称为代谢重编程[15]。肿瘤细胞的代谢重编程主要表现在两个方面:糖代谢异常和谷氨酰胺代谢异常。Warburg效应在包括胰腺癌在内的许多肿瘤中都存在,与正常细胞相比,肿瘤细胞需摄取更多的葡萄糖,并通过糖酵解将其转化为乳酸,糖酵解为肿瘤细胞的生长和分裂提供能量和大量的中间代谢物,其产物乳酸作为代谢底物可被细胞摄取再次利用[16]。多种肿瘤细胞均存在大量消耗并利用谷氨酰胺的代谢特点,表现出“谷氨酰胺依赖”的现象[17]。谷氨酰胺进入三羧酸循环,为细胞提供中间代谢产物和能量,代谢产物是合成嘌呤、嘧啶核苷酸、脂肪酸和其他氨基酸的碳源和氮源。EGCG作用于谷氨酰胺代谢途径的关键酶即谷氨酸脱氢酶,用于在葡萄糖剥夺或糖酵解抑制期间杀死谷氨酰胺上瘾的癌细胞[18]。研究表明PI3K-Akt信号通路在人类肿瘤谱中普遍失调,该通路可调节肿瘤细胞的增殖和存活,并与肿瘤的代谢重编程密切相关。本研究探索了EGCG能否通过PI3K-Akt信号通路抑制胰腺癌细胞的糖酵解,结果显示EGCG达到50 μmol/L时可抑制胰腺癌PANC-1细胞的糖酵解,随着浓度升高,抑制作用越明显,EGCG抑制了糖酵酶HK-2、PFK和LDH的表达,同时抑制了磷酸化PI3K和Akt的表达。
-
综上所述,EGCG能抑制胰腺癌细胞的增殖和糖酵解,其作用机制可能是通过抑制PI3K/Akt通路实现。
-
参考文献
-
[1] Mizrahi JD,Surana R,Valle JW,et al.Pancreatic cancer[J].Lancet,2020,395(10242):2008-2020.
-
[2] Lin QJ,Yang F,Jin C,et al.Current status and progress of pancreatic cancer in China[J].World J Gastroenterol,2015,21(26):7988-8003.
-
[3] Warburg O.On the origin of cancer cells[J].Science,1956,123(3191):309-314.
-
[4] Almatroodi SA,Almatroudi A,Khan AA,et al.Potential therapeutic targets of epigallocatechin gallate(EGCG),the most abundant catechin in green tea,and its role in the therapy of various types of cancer[J].Molecules,2020,25(14):3146.
-
[5] Hu LJ,Chen XJ,Qiu S,et al.Intra-pancreatic insulin nourishes cancer cells:do insulin-receptor antagonists such as PGG and EGCG play a role?[J].Am J Chin Med,2020,48(4):1005-1019.
-
[6] 李哲,钱佳乐,向敏,等.EGCG通过抑制谷氨酰胺代谢通路抑制结直肠癌细胞的生长的实验研究[J].药学与临床研究,2018,26(3):166-170.
-
[7] Mokra D,Joskova M,Mokry J.Therapeutic effects of green tea polyphenol(‒)-epigallocatechin-3-gallate(EGCG)in relation to molecular pathways controlling inflammation,oxidative stress,and apoptosis[J].Int J Mol Sci,2022,24(1):340.
-
[8] Suhail M,Rehan M,Tarique M,et al.Targeting a transcription factor NF-κB by green tea catechins using in silico and in vitro studies in pancreatic cancer[J].Front Nutr,2022,9:1078642.
-
[9] Chen ZK,Wei YF,Zheng YZ,et al.SERPINB2,an early responsive gene to epigallocatechin gallate,inhibits migration and promotes apoptosis in esophageal cancer cells[J].Cells,2022,11(23):3852.
-
[10] Farabegoli F,Granja A,Magalhães J,et al.Epigallocatechin-3-gallate delivered in nanoparticles increases cytotoxicity in three breast carcinoma cell lines[J].ACS Omega,2022,7(46):41872-41881.
-
[11] Sah DK,Khoi PN,Li SN,et al.(-)-epigallocatechin-3-gallate prevents IL-1β-induced uPAR expression and invasiveness via the suppression of NF-κB and AP-1 in human bladder cancer cells[J].Int J Mol Sci,2022,23(22):14008.
-
[12] Wang L,Li PH,Feng K.EGCG adjuvant chemotherapy:current status and future perspectives[J].Eur J Med Chem,2023,250:115197.
-
[13] Sharifi-Rad M,Pezzani R,Redaelli M,et al.Preclinical pharmacological activities of epigallocatechin-3-gallate in signaling pathways:an update on cancer[J].Molecules,2020,25(3):467.
-
[14] Mayer BFB,Stagno MJ,Fuchs J,et al.Epigallocatechin gallate inhibits cell growth and hedgehog signalling in human rhabdomyosarcoma cell lines[J].Anticancer Res,2023,43(3):1025-1030.
-
[15] Yoshida GJ.Metabolic reprogramming:the emerging concept and associated therapeutic strategies[J].J Exp Clin Cancer Res,2015,34:111.
-
[16] Faubert B,Li KY,Cai L,et al.Lactate metabolism in human lung tumors[J].Cell,2017,171(2):358-371.e9.
-
[17] Yoo HC,Yu YC,Sung Y,et al.Glutamine reliance in cell metabolism[J].Exp Mol Med,2020,52(9):1496-1516.
-
[18] Hensley CT,Wasti AT,DeBerardinis RJ.Glutamine and cancer:cell biology,physiology,and clinical opportunities[J].J Clin Invest,2013,123(9):3678-3684.
-
摘要
目的:探讨表没食子儿茶素没食子酸酯(EGCG)对胰腺癌细胞的增殖及糖代谢的影响。方法:用CCK8试剂盒检测不同浓度EGCG对胰腺癌PANC-1细胞增殖的影响,用葡萄糖乳酸试剂盒检测EGCG对糖酵解的影响,Western blot法检测糖酵解酶及PI3K/Akt通路蛋白的表达。结果:CCK8结果显示,EGCG可以抑制PANC-1细胞的增殖,其抑制作用具有剂量依赖性和时间依赖性(P<0.05)。葡萄糖乳酸检测实验表明,EGCG可以抑制PANC-1细胞的葡萄糖消耗和乳酸生成(P<0.05)。Western blot结果表明,EGCG可以抑制糖酵解酶己糖激酶-2(HK-2)、磷酸果糖激酶(PFK)和乳酸脱氢酶(LDH)及磷酸化PI3K和Akt的表达,且EGCG浓度越高,抑制作用越明显(P<0.05)。结论:EGCG抑制人胰腺癌细胞系PANC-1的增殖和糖酵解,其抑制作用可能与抑制PANC-1细胞中PI3K/Akt通路有关。
Abstract
Objective To investigate the effects of epigallocatechin gallate (EGCG) on the proliferation and glucose metabolism of pancreatic cancer cells. Methods Human pancreatic cancer PANC-1 cells were treated with different concentrations of EGCG, and the proliferation of PANC-1 cells was assessed by CCK8 method. The effects of EGCG on PANC-1 cell glycolysis were detected by glucose consumption and lactate production, and the expressions of glycolytic enzyme and PI3K/Akt pathway protein were detected by Western blot. Results The results of CCK8 assay showed that EGCG inhibited the proliferation of pancreatic cancer PANC-1 cells in a dose- and time-dependent manner (P<0.05). EGCG also inhibited the glucose consumption and lactate production of PANC-1 cells (P<0.05). Compared with the control group, EGCG inhibited the expression of glycolytic enzyme and PI3K/Akt pathway protein in a dose-dependent manner (P<0.05). Conclusion EGCG can inhibit the proliferation and glycolysis of human pancreatic cancer cells, which may be related to the inhibition of PI3K/Akt pathway in PANC-1 cells.
关键词
胰腺癌 ; 表没食子儿茶素没食子酸酯 ; 糖酵解 ; 细胞增殖 ; PI3K/Akt通路